矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处所指的风化作用是指矿物与水和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭土〔Al2Si2O5(OH)4〕,此反应的离子方程式为2KAlSi3O8+2CO2+11H2O====2K++2 +4H4SiO4+Al2Si2O5(OH)4,这个反应能够发生的原因是____________________________。
+4H4SiO4+Al2Si2O5(OH)4,这个反应能够发生的原因是____________________________。
(共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为  ,则生成沉淀所需CaCl2溶液的最小浓度为。
,则生成沉淀所需CaCl2溶液的最小浓度为。
(3)己知: 

则反应 
有七种物质:① 铝,② A12O3,③ 稀硝酸,④ NaHCO3,⑤ Ba(OH)2固体,⑥ 氨水,⑦ A12(SO4)3,根据下列要求回答问题:
(1)属于电解质的是(填序号)。
(2)既能与强酸反应,又能与强碱反应的是(填序号)。
(3)34.2 g ⑦ 溶于水配成500 mL溶液,溶液中SO42-的物质的量浓度为。
(4)①与③发生反应的化学方程式为A1+4HNO3=A1(NO3)3+NO↑+2H2O,该反应中还原剂与氧化剂的物质的量之比是。
(12分)(1)现用氯化铜晶体(CuCl2.2H2O,含少量FeCl2杂质)制取纯净的CuCl2.H2O先将其制成水溶液,后按如图步骤进行提纯: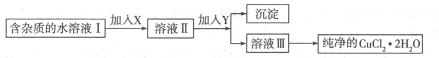
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表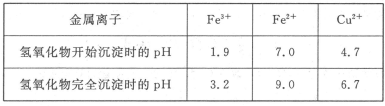
请回答下列问题:
①请从下列物质中选出第一步中需加入的X
a.NaClOb.H2O2
c.KMnO4d.HNO3
②如何检验溶液Ⅱ中除Cu2+外的金属阳离子:________________________________。
③由溶液Ⅲ得到CuCl2.2H2O晶体的操作是___________________________________.
(2)某化学兴趣小组取一定量的双氧水,欲准确测定其中H2O2的含量:
取双氧水25. 00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准溶液滴定,其反应的离子方程式为: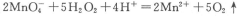
(1)滴定时,将高锰酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中,滴定到达终点的现象是________________________________________________
(2)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____(填“偏高”或“偏低”或“不变”)。
(15分)如图所示的装置,X、Y都是惰性电极。将电路接通后,向(乙)中滴人酚酞溶液,在Fe极附近显红色。试回答下列问题: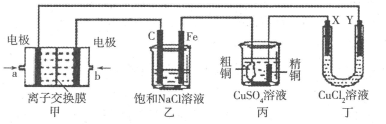
(1)(甲)装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是_______(填“CH4”或“O2”),b处电极上发生的电极反应式是____;
(2)在(乙)装置中,石墨(C)电极上发生_______反应(填“氧化”或“还原”);(乙)装置中总反应的离子方程式是:___________________________________.
(3)如果(丙)装置中精铜电极的质量增加了6.4g,则(乙)装置中,铁电极上产生的气体在标准状况下为____,(甲)装置中消耗的 CH4的质量为____。
(4)(丁)装置中X电极为_______极(填“正”、“负”、“阳”、“阴”),在通电一段时间后,Y电极上发生的电极反应式是_______。
(16分)I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题: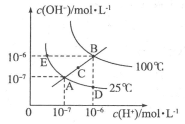
(1)图中A、B、C、D四点的 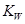 由大到小的顺序:______。
由大到小的顺序:______。
(2)若从A点到D点,可采用的方法是________________________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为____。
Ⅱ.(1)室温下,向氨水中加入稀盐酸,使其恰好完全中和,所得溶液的pH_______7(填“>”、“<”或“=”),用离子方程式表示其原因________________________,所得溶液中各离子物质的量浓度由大到小的顺序为____________;
(2)氨水中加入少量氯化铵固体,NH3.H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中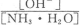 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。