托盘天平两盘内分别放入一个质量相同的烧杯,烧杯里有100 mL 1 mol·L-1H2SO4,天平平衡。向烧杯中加入下列哪些物质经反应后,天平仍保持平衡的是( )
| A.各10 g的Mg和Zn |
| B.各1 g的Mg和Zn |
| C.各0.1 mol的Mg和Zn |
| D.6.5 g的Mg,0.1 mol Zn |
根据下图提供的信息,下列所得结论正确的是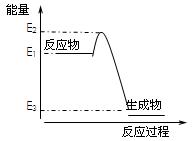
| A.该反应是吸热反应 |
| B.该反应的生成物比反应物稳定 |
| C.该反应一定可以设计成为原电池 |
| D.该反应向外界放出的热量为E2-E3 |
下列叙述正确的是:
| A.P4和CO2均由共价化合物分子构成 |
| B.CCl4和NH4Cl中均存在共价键 |
C.Na2 O和C60晶体中都不存在单个小分子 O和C60晶体中都不存在单个小分子 |
| D.CH4分子是平面型分子,NH3分子的空间构型为三角锥形 |
运用元素周期律来判断,则下列叙述中不正确的是
| A.元素Be的金属性比Na的金属性弱 |
| B.At是第6周期第ⅦA族元素,HAt不稳定,且AgAt是有色难溶于水的物质 |
| C.Sr是第5周期第ⅡA族元素,则SrSO4可能难溶于水,Sr(OH)2为强碱 |
| D.As是第4周期第ⅤA 族元素,则AsH3比NH3更稳定 |
可逆反应:2A(g) + 3B(g) 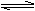 3C(g),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是
3C(g),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是
A.各物质的浓度之比为c(A):c(B):c(C) = 2:3:3
B.A、B、C三者共存
C.混合气体的总质量不变
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.增加Fe的质量 |
| C.滴加几滴CuSO4溶液 | D.不用铁片,改用铁粉 |