(12分)2009年2月3日下午,山西省太原市第四人民医院举行了祝贺太原禽流感患儿彭杰(女)康复出院及病情报告会。禽流感病毒是一种没有超常抵抗力的病毒。研究证明,许多常用消毒药品如漂粉精、漂白粉、高锰酸钾等,都可以将禽流感病毒杀灭。氯气及氢氧化钙充分反应,使次氯酸钙成为主要成分,得到漂粉精,其稳定性比漂白粉高。
将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为______________________________。另取少许上层清液,先滴加适量的________(填化学式)酸化,再滴加________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________________。再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈______性并具有______性。
下列是中学常见的一些物质之间的转化关系(其中部分反应产物省略),其中I是一种金属单质,A是一种黄绿色的非金属单质;F、M、N均为难溶于水的白色沉淀物质,M和N不溶于稀硝酸;B是一种具有刺激性气味的气体,且具有漂白性;C和D是中学化学中两种常见的强酸。请回答下列问题: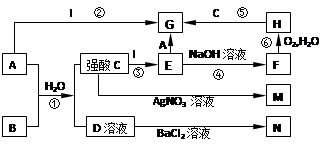
(1)写出物质B和M的化学式:B., M.;
(2)写出E→G转化反应的离子方程式:;
(3)写出反应⑥的化学方程式:;
(4)写出反应⑤的离子方程式: 。
氧化还原反应是重要的一类化学反应。
(1)在化学反应2KMnO4 + 10KI + 8H2SO4=6K2SO4+ 2MnSO4 + 5I2 + 8H2O中,化合价降低的元素是 ,发生氧化反应的物质是。
(2)据反应8NH3 + 3Cl2=6NH4Cl + N2回答下列问题:
①该反应中,氧化剂是 ,还原剂是。
②该反应中,当有8mol NH3反应时,转移电子总量是mol。
③参加反应的氧化剂与还原剂的物质的量之比为 (最简整数比)。
④当有3mol e- 转移时,该反应生成的氧化产物的质量是g。
铁是人类较早使用的金属之一,根据所学铁及其化合物的知识,回答下列问题:
(1)下列各物质中,不能和单质铝反应的物质是(填下列各项序号)。
①Fe②FeCl3③FeSO4
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,实验得到的分散系
属于(填“溶液”“浊液”或“胶体”),所得到的分散系中的分散质具有的性质有如下的(填写序号)。
①电泳②透过半透膜③聚沉④具有强还原性
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式:;证明反应后的溶液中存在Fe3+的实验方法是。
现有下列六种物质,请根据要求填空(填写序号):
①氢氧化钠②氯化镁 ③二氧化碳 ④稀氨水 ⑤氢氧化铁胶体
(1)属于电解质的是
(2)属于混合物的是
(3)属于酸性氧化物的是
(10分)如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹;x、y分别为直流电源的两极。在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,生成气体如图所示。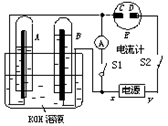
请回答下列问题:
(1)标出电源的正、负极:x为 。
(2)在滤纸的C端附近,观察到的现象是 。
(3)写出电极反应式:B电极 。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2闭合开关S1,则电流计的指针是否发生偏转 (填“偏转”或“不偏转”)。
(5)若电流计指针偏转,写出有关的电极反应(若指针“不偏转”,此题不必回答。);
。
若电流计指针不偏转,请说明理由(若指针“偏转”,此题不必回答) 。