(12分)在右图所示的实验装置中,A中盛有品红溶液,B中盛有NaOH溶液。 请回答下列问题:
请回答下列问题:
(1)若向A中通入足量的二氧化硫气体,A中的现象是______________________。
(2)若向A中通入足量的氯气后,再加热A,A中的溶液______(填“能”或“不能”)恢复到原来的颜色。
(3)如果A中盛的是氨水,B中盛的是无色酚酞溶液,微热A,B中溶液会变为红色,则此时表现氨水具有______性和______性。
(4)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和______性。
(5)如果A中盛的是盐酸,加入铜粉,为了让铜粉溶解,可以加入NaNO3,反应的离子方程式为:3Cu+2NO+8H+===3Cu2++2NO↑+4H2O,请用单线桥标出其电子转移的方向和数目。
用Na2CO3·10H2O晶体,配制0.2 mol/L的Na2CO3溶液480 mL。
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_____________,____________;
(2)应用托盘天平称取Na2CO3·10H2O的晶体的质量为_________________g;
(3)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容
正确的操作顺序是__________________(填序号)。
(4)根据下列操作对所配溶液的浓度各有什么影响,完成填空。
①碳酸钠晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
其中引起所配溶液浓度偏高的有____________,无影响的有________。(填序号)
某同学探究同周期元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将一小块金属钠放入滴有酚酞的冷水中 |
A.剧烈反应,产生大量无色气体。 |
| ②将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加酚酞溶液 |
B.浮在水面,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ③将镁条放入稀盐酸中 |
C.生成淡黄色沉淀。 |
| ④将铝条放入稀盐酸中 |
D.反应较快,产生无色气体。 |
| ⑤向AlCl3溶液中滴加NaOH 溶液至过量 |
E.有气体产生,溶液变成浅红色。 |
| ⑥向新制的Na2S溶液中滴加新制的氯水 |
F.产生白色胶状沉淀,继而沉淀消失。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究同周期元素性质递变规律。
(2)实验药品:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH 溶液等。
实验仪器:试管、试管夹、酒精灯、胶头滴管、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(填写与实验步骤对应的实验现象的标号和化学方程式)
| 实验内容 |
实验现象 |
化学方程式 |
| ① |
B |
|
| ② |
Mg + 2H2O  Mg(OH)2 + 2H2 ↑ Mg(OH)2 + 2H2 ↑ |
|
| ③ |
Mg + 2HCl = MgCl2 + H2↑ |
|
| ④ |
D |
|
| ⑤ |
AlCl3 + 3NaOH = Al(OH)3↓+ 3NaCl Al(OH)3 + NaOH =NaAlO2+ 2H2O |
|
| ⑥ |
Na2S + Cl2 =" 2NaCl" + S↓ |
(4)实验结论:。
CoCl2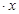 H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2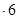 H2O的一种新工艺流程如下图:
H2O的一种新工艺流程如下图: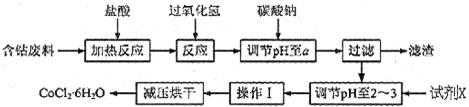
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2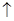
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
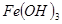 |
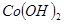 |
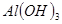 |
| 开始沉淀 |
2.3 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.2 |
5.2 |
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:__________
(2)加入碳酸钠调节pH至a,a的范围是__________;
(3)最合适的试剂X是__________
(4)操作I包含3个基本实验操作,它们是__________、__________和减压过滤。
(5)制得的CoCl2·6H2O需减压烘干的原因是__________。
实验和探究对化学学科的发展起着非常重要的作用
(1)写出下列实验过程中所体现的总的离子反应方程式:
①用PH试纸测得醋酸钠溶液呈碱性:__________
②用石墨做电极,电解硝酸银溶液后,溶液呈酸性:__________
③根据浑浊出现的快慢,探究硫代硫酸钠与酸反应速率的影响因素:__________
(2)已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6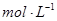 NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为
NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为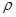 ,则h=__________
,则h=__________
(3)实验室测定绿矾中FeSO4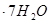 含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有: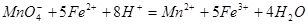
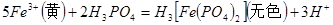
①绿矾的含量为__________%。
②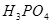 的作用是__________。
的作用是__________。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式。
(2)饱和碳酸钠溶液的主要作用是。
(3)浓硫酸的作用是与。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。