为了验证浓H2SO4和木炭在加热时发生反应生成的各种产物,甲、乙两学生分别设计如下实验方案:(图中→表示气体流向)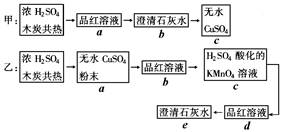
(1)上述方案可达到实验目的的是______________(填“甲”或“乙”)。
(2)具体说明能达到实验目的的方案中,气体通过的各装置(用字母表示)的作用: 。
某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为___________g.
(本题8分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来 ,将乙针筒内的物质压到甲针筒内,进行下表所列的不伺实验(气体在同温同压下测定)。
,将乙针筒内的物质压到甲针筒内,进行下表所列的不伺实验(气体在同温同压下测定)。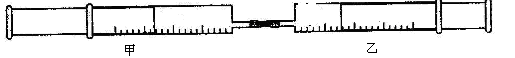
试回答下列问题:
(1)实验1中,沉淀最终变为:色,写出沉淀变色 的化学方程式。
的化学方程式。
(2)实验2中,已知:3Cl2+2NH3=N2+6HCl。甲针筒除活塞有移动, 针筒内有白烟产生外,气体的颜色变化为,最后两个针筒中共剩余气体的体积约为mL。
(本题2分)下列有关实验的叙述,正确的是(填序号).()
| A.浓硫酸不小心沾到皮肤上,立即用稀NaOH溶液洗涤 |
| B.用重结晶法提纯含少量NaCl的KNO3晶体 |
| C.用分液漏斗将甘油和水的混合液体分离 |
| D.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比 |
E.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下: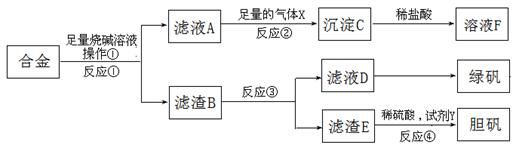
请回答:
(1)操作①用到的玻璃仪器有。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式。
(3)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是。
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________;
②该同学的判断不正确,原因是_________________;
(4)请设计实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象______。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。