(本题8分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来 ,将乙针筒内的物质压到甲针筒内,进行下表所列的不伺实验(气体在同温同压下测定)。
,将乙针筒内的物质压到甲针筒内,进行下表所列的不伺实验(气体在同温同压下测定)。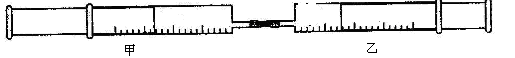
试回答下列问题:
(1)实验1中,沉淀最终变为: 色,写出沉淀变色 的化学方程式 。
的化学方程式 。
(2)实验2中,已知:3Cl2+2NH3=N2+6HCl。甲针筒除活塞有移动, 针筒内有白烟产生外,气体的颜色变化为 ,最后两个针筒中共剩余气体的体积约为 mL。
(碱式氧化镍 (Ni00H)可用作镍氢电池的正极材料。以含镍(Ni2+ )废液为原料生产 Ni00H的一种工艺流程如下:
(1)加入Na2C03溶液时,证明Ni2+已经完全沉淀的实验方法是 ,过滤时需用到的玻璃仪器有烧杯、 。
(2)写出碳酸镍与稀硫酸反应的离子方程式 : 。
(3)硫酸镍溶液可用于制备合成氨的催化剂C0ni(1-n) Fe204。
如图表示在其他条件相同时合成氨的相对初始速率随催化剂中w值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是 。
(4)写出在空气中加热Ni(0H)2NK0H)制取Ni00H的化学方程式: 。
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。 某化学兴趣小组对氯及其化合物进行探究。
(1)漂白精广泛用于饮用水消毒、医院环境消毒、游泳池消毒。资料查阅:随漂白精溶液酸性的增强,溶液会变为黄绿色。出现该现象的原因为 (用离子方程式表示)。
(2)实验室可用氯气与金属铁反应制备无水三氯化铁,三氯化铁呈棕红色、易潮解,100 左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。
①仪器X的名称为 。
②制备三氯化铁的反应开始前,需排除装置中的空气,采取的方法是 。
③实验装置的连接顺序是a 。
(3)设计实验证明FeCL3的氧化性比I2强: 。
某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示:
已知:l.0mol·L﹣1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 , 分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;猜想2:在酸性条件下SO2与NO3﹣反应;猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色。
【得出结论】:猜想1成立.其结论正确吗? (填“是”或“否”)。若不正确,理由是
(用离子方程式表示)。
(5)乙同学设计实验验证猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 (填序号)。
a.0.1mol/L稀硝酸 b.1.5mol/LFe(NO3)2溶液
c.6.0mol/LNaNO3和0.2mol/L盐酸等体积混合的溶液
d.3.0mol/LNaNO3和0.1mol/L硫酸等体积混合的溶液
(6)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程: 、 。
某实验需要100 mL、0.1 mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用________(填仪器名称)搅拌;②把①所得溶液冷却到室温后,小心转入________(填仪器名称);③继续加蒸馏水至液面距刻度线1~2 cm处,改用________(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是________(填序号)。
(2)若没有操作④,则所配溶液的浓度会________(填“偏高”或“偏低”)。
(3)若取出20 mL配好的Na2CO3溶液,加蒸馏水稀释成c(Na+)=0.01 mol/L的溶液,则稀释后溶液的体积为________mL。
(4)在配制100 mL 0.1 mol/L的Na2CO3溶液时,下列操作中的________会导致结果偏低(请用序号填写)。
①用托盘天平称量时砝码放在左盘 ②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外 ③定容时俯视刻度线 ④定容时仰视刻度线 ⑤干净的容量瓶未经干燥就用于配制溶液
乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下: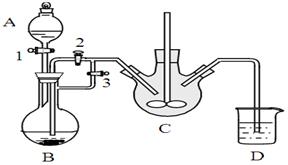
|