Ⅰ.化学是一门以实验为基础的学科,下列实验操作描述中正确的是( )
①为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
②用托盘天平称取10. 4 g食盐时,将食盐放在右盘中的纸片上称量
③配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥,对实验结果无影响
④以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液时,锥形瓶水洗后又用待测液润洗
⑤测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
⑥用标准浓度的盐酸滴定NaOH溶液时,滴定前仰视读数,滴定后俯视读数,这种操作将造成待测烧碱溶液浓度偏高
Ⅱ.某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答。
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品。
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有__________________。
③用________量取10.00ml待测液,注入锥形瓶中。
④在锥形瓶中滴入2~3滴________(填指示剂),用0.2010 mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转__ 式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。
(2)该小组测得下列数据
| 滴定次数 |
待测液体积/ml |
标准盐酸体积/ml |
|
| 滴定前读数/ml |
滴定后读数/ml |
||
| 第一次 |
10.00 |
0.20 |
22.90 |
| 第二次 |
10.00 |
0.50 |
20.40 |
| 第三次 |
10.00 |
4.00 |
24.10 |
| 第四次 |
10.00 |
0.00 |
20.00 |
根据上述数据,计算烧碱的纯度______________。
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。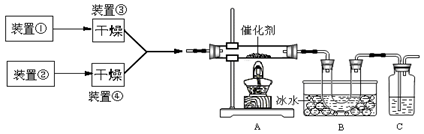
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。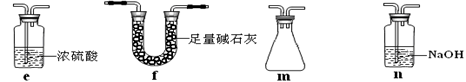
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。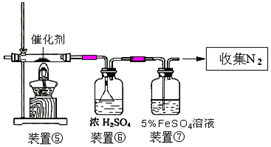
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):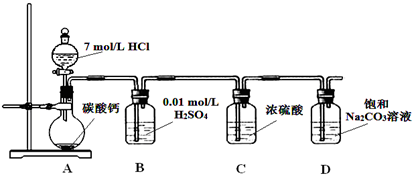
(1)请结合化学平衡移动原理解释B中溶液的作用 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器b中可选择的试剂为(任意填一种) 。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为 。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积 (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据 (填序号)。
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是 。
某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是 (用化学方程式表示),所以他认为应该检验 (填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。
(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号) 。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸;④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用 。
(4)C装置中出现的现象是 ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 。
CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下: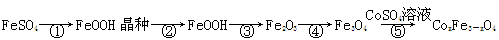
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为;
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是,吹入空气的作用为。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为。
(5)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品。检验粗产品洗涤干净的实验操作和现象是。
(6)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Co2+ |
6.9 |
9.4 |
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
②。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: 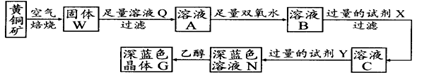
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表: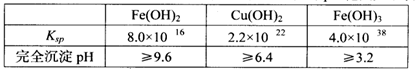
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式:;
(2)试剂X的化学式为;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为,用pH试纸测该溶液pH值的方法是;
(4)在溶液N中加入乙醇的目的是。