下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
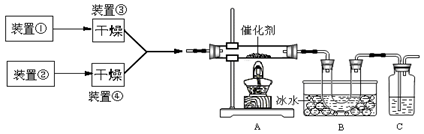
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
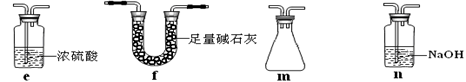
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
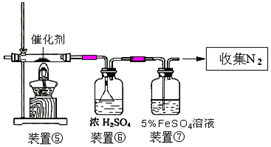
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
某校课外活动小组同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分。
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:;
(2)A装置中品红溶液颜色(填“褪色”或“不褪色”),证明含有气体;
(3)装置B的作用是除去某种气体,这主要是利用了该气体的性质来实现目的;
【实验讨论】
(4)有同学对B装置能否除尽SO2气体有疑义。你认为应该在B、C装置之间连接下图中的
装置,以确认SO2是否除尽;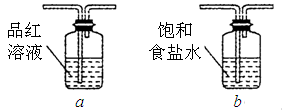
【联系实际】
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是_________,二氧化碳造成的环境影响主要是_______。(每空格只填一个选项)
A.酸雨B.破坏臭氧层C.温室效应D.光化学烟雾
酸碱中和滴定是中学化学中重要的定量实验之一。
Ⅰ.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol·L-1的盐酸进行滴定(杂质不与盐酸反应)。
根据要求回答下列问题:
(1)配制250 mL 0.040mol·L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和______________。
(2)为测定该苛性钠溶液的准确浓度,几次滴定消耗盐酸的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗盐酸溶液的体积(mL) |
20.05 |
20.00 |
22.10 |
19.95 |
①计算苛性钠浓度时,哪次实验的数据不宜采用?答:________。(填实验序号)
②该苛性钠溶液的浓度为___________。
(3)若操作过程中未用盐酸润洗滴定管,对测定结果有怎样的影响?
答:______________________(填“偏大”、“偏小”或“无影响”)。
Ⅱ.在另一次实验中,研究性小组将V1 mL 1.0mol·L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2="50" mL)。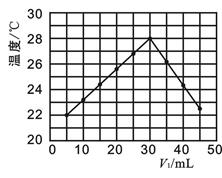
(4)下列叙述中正确的是_________
A.该实验的环境温度为22℃
B.当V1 =40时,溶液中c(Na+)<c(Cl—)
C.NaOH溶液的浓度为1.0mol·L-1
D.保持其他条件不变,只将HCl改为CH3COOH进行实验,也得到如图的实验结果
某实验小组同学为了探究SO2的性质,进行了如下实验(实验前,装置内空气已排尽):
已知:硫酸的沸点是338℃,酒精灯可加热至400℃以上。
主要实验步骤:
①加热试管A直到B、D中均出现大量白色沉淀,熄灭酒精灯;
②将Cu丝上提离开液面;
③从导管F口向装置中通入空气一段时间。
(1)试管A中发生的主要反应的化学方程式为。
(2)试管B中出现白色沉淀的原因是。
(3)试管C中溶液褪色,说明SO2具有(填“漂白性”或“氧化性”或“还原性”),请将该反应的离子方程式补充完整:
(4)试管D中发生反应的离子方程式为。
(5)下列叙述正确的是。
a.上下移动铜丝可控制生成SO2的量
b.为确认有CuSO4生成,可向试管A中加水,观察颜色
c.步骤③可使装置中残留气体完全被吸收,避免污染空气
d.熄灭酒精灯后, B中的液体不会倒吸,因为空气可经导管F进入试管A,使压强平衡
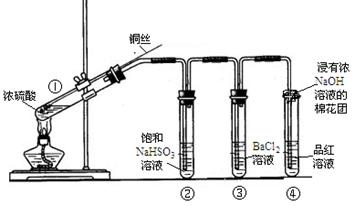
下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。
|
| 加入试剂 |
现象 |
反应的离子方程式 |
|
| 第一份 |
加入NaOH溶液 |
有白色沉淀生成 |
____________ |
| 第二份 |
加入氯水 |
有白色沉淀生成 |
____________ |
完成上述反应的离子方程式。
(4)④中棉花团的作用是 。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是 。
某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
| 实验序号 |
实验步骤(内容) |
现象 |
| ① |
在贴有标签a、b的试管中分别加入1.0 g Na2CO3固体和NaHCO3固体,观察外观。 |
|
| ② |
分别滴入几滴水,振荡,摸试管底部。 |
试管放热现象更明显(填“a”或“b”)。 |
| ③ |
继续向两试管中分别加入10.0 mL水,用力振荡,观察现象。 |
|
| ④ |
再分别向两试管中滴加2滴酚酞溶液,观察现象。 |
溶液均变红,颜色较深的试管是_________(填“a”或“b”)。 |
| ⑤ |
最后分别向两溶液中滴加足量盐酸。 |
红色褪去,均有无色气体产生。经计算生成气体的量a_____b(填“>”“<”或“=”)。 |
| ⑥ |
加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末) |
(1)请帮助该小组同学完成实验报告中的内容。
(2)已知:20℃时Na2CO3的溶解度为20.5 g。由实验(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5 g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是,化学方程式是。
(3)由实验⑥可以得出的结论是,用化学方程式说明得出结论的原因。