某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
| 实验序号 |
实验步骤(内容) |
现象 |
| ① |
在贴有标签a、b的试管中分别加入1.0 g Na2CO3固体和NaHCO3固体,观察外观。 |
|
| ② |
分别滴入几滴水,振荡,摸试管底部。 |
试管 放热现象更明显(填“a”或“b”)。 |
| ③ |
继续向两试管中分别加入10.0 mL水,用力振荡,观察现象。 |
|
| ④ |
再分别向两试管中滴加2滴酚酞溶液,观察现象。 |
溶液均变红,颜色较深的试管是_________(填“a”或“b”)。 |
| ⑤ |
最后分别向两溶液中滴加足量盐酸。 |
红色褪去,均有无色气体产生。经计算生成气体的量a_____b(填“>”“<”或“=”)。 |
| ⑥ |
加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末) |
|
(1)请帮助该小组同学完成实验报告中的内容。
(2)已知:20℃时Na2CO3的溶解度为20.5 g。由实验 (填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5 g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是 ,化学方程式是 。
(3)由实验⑥可以得出的结论是 ,用化学方程式说明得出结论的原因 。
在实验室里用乙醇和浓硫酸反应生成乙烯,再用溴与乙烯反应生成1,2-二溴乙烷,可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:
| 乙醇 |
1,2二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
(1)用下列仪器制备1,2-二溴乙烷。如果气体流向为从左到右,则正确的连接顺序是(短接口或橡皮管均已略去): 经A(1)插入A中, 接A(2),A(3)接 接 接 接 (填大写字母代号)。
(2)温度计水银球的正确位置是 。
a、支管口处 b、液面上方 c、液面以下
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a、水 b、氢氧化钠溶液 c、碘化钠溶液 d、乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置E,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
)化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置。
完成下列问题: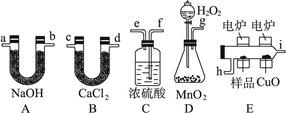
(1)按产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是
_;
(2)C装置中浓硫酸的作用是;
(3)D装置中MnO2的作用是;
(4)燃烧管中CuO的作用是;
(5)若准确称取9.0 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加13.2 g,B管质量增加5.4 g,则该有机物的实验式为____________________;
(6)要确定该有机物的分子式,还要。
Ⅰ、下列实验操作不正确的是 ;
①用分液漏斗分离环己烷和苯的混合液体
②将10滴溴乙烷加入到1 mL 10%的烧碱溶液中,加热片刻后,冷却,先加过量的硝酸,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
③分离苯和苯的同系物,可以采用蒸馏的方法。
④实验室制溴苯时选用的试剂可以是溴水、苯和铁屑
Ⅱ、为检验利用溴乙烷发生消去反应后生成的气体中是否含乙烯的装置如右图所示。回答:
(1)溴乙烷发生消去反应的化学方程式为:;
(2)试管a的作用是;
(3)若省去试管a,试管b中试剂为。
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯。
请分析后回答下列问题
(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶的A口加少量液溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式为
。
(2)D试管内出现的现象为。
(3)E试管内出现的现象为。
(4)三颈烧瓶右侧导管特别长,除导气外还起的作用是。
(5)待三颈烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C夹,可以看到的现象是 ____。
(6)反应结束后将三颈烧瓶中的溴苯分离实验方法是。(铁屑已分离)
文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究:
(1) 提出合理的假设:该酸雨中的溶质除H2SO4、HCl外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有。
(2) 设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用。 |
|
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤。 |
|
| 步骤3:取少量步骤2得到的滤渣加入足量的盐酸。 |
|
| 步骤4:取少量步骤2得到的的滤液,加入 。 |
|
| 步骤5:往B试管中加入 。 |