下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:

(1) 仪器A的名称是 ;
(2) 盐酸的体积读数:滴定前读数为 mL,滴定后读数为 mL 。
(3) 某实验小组同学的三次实验的实验数据如下表所示。 根据表中数据计算出的待测NaOH溶液的平均浓度是 mol/L。(保留四位有效数字)
| 实验 编号 |
待测NaOH溶液的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 |
20.00 |
1.20 |
23.22 |
| 2 |
20.00 |
2.21 |
24.21 |
| 3 |
20.00 |
1.50 |
23.48 |
(4)若用酚酞做指示剂,判断到达滴定终点的实验现象是_____________
(5) 对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 若滴定前锥形瓶未用待测液润洗,对测定结果的影响是 ;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失。_________
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是 ;
氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下: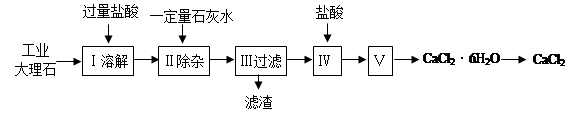 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、;需要量取36.5%的盐酸mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是。
| A.定容摇匀后发现液面低于刻度线 |
| B.定容时俯视容量瓶的刻度线 |
| C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
| D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(2)步骤Ⅰ中有关反应的离子方程式有:、、。
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示):。
(4)滤渣的主要成分有(写化学式)。
(5)步骤Ⅴ所含的操作依次是 、。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④、;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。
实验题
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
| 实验编号 |
V(烧碱溶液)/mL |
V(盐酸)/mL |
|
| 初始读数 |
末尾读数 |
||
| 1 |
10.00 |
0.50 |
21.52 |
| 2 |
10.00 |
1.00 |
21.98 |
| 3 |
10.00 |
0.20 |
24.80 |
试回答:
①滴定时右手的正确操作是______________________________________。
②判断到达滴定终点的实验现象是__________________________________________,依据表中数据,计算出烧碱样品中含NaOH的质量分数为_______%。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(2)氧化还原滴定实验同中和滴定类似。过氧化氢是重要的氧化剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度。已知:2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑,请填写下列空白:
①用(填“酸式”或“碱式”)滴定管移取过氧化氢溶液25.00 mL至锥形瓶中,作被测试样。
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中,高锰酸钾标准溶液用酸式滴定管原因为。③重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的物质的量浓度为。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快。某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究。
实验Ⅰ:在2支试管中分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表1:
| 试管 |
未加MnSO4的试管 |
加有MnSO4的试管 |
| 褪色时间 |
30 s |
2 s |
[表1]
实验Ⅱ:另取2支试管分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表2:
| 试管 |
未滴加稀硫酸的试管 |
滴加了稀硫酸的试管 |
| 褪色时间 |
100 s |
90 s |
[表2]
实验Ⅲ:另取3支试管分别加入5 mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1 mL、2 mL稀硫酸溶液,再各加入5滴0.1 mol·L-1 KMnO4溶液,然后置于温度为65℃的水浴中加热。记录溶液褪色时间,如表3:
| 试管 |
滴入10滴稀硫酸的试管 |
加入1 mL稀硫酸的试管 |
加入2 mL稀硫酸的试管 |
| 褪色时间 |
70 s |
100 s |
120 s |
[表3]
(1)实验Ⅰ得出的结论是_____。
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:_____。[来
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利[
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:____。实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色_____,且30 s不改变。滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度____(选填:偏大、偏小、无影响)。
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
上述实验中,实验_____可证明这个历程是可信的。
单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解 ,有关物质的物理常数见下表:
,有关物质的物理常数见下表:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
| 沸点/℃ |
57.7 |
- |
315 |
| 熔点/℃ |
-70.0 |
- |
- |
| 升华温度/℃ |
- |
180 |
300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是。 (2)装置C中的试剂是; D、E间导管短且粗的原因是。
(2)装置C中的试剂是; D、E间导管短且粗的原因是。 (3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3:。
【设计方案,进行实验】可供选择的实验试剂有:3mol/LH2SO4、1mol/LNaOH、0.01mol/LKMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
| 序号 |
操作 |
可能出现的现象 |
结论 |
| ① |
向a试管中滴加几滴溶液 |
若溶液褪色 |
则假设1成立 |
| 若溶液不褪色 |
则假设2或3成立 |
||
| ② |
向b试管中滴加几滴溶液 |
若溶液褪色 |
则假设1或3成立 |
| 若溶液不褪色 |
假设2成立 |
||
| ③ |
向c试管中滴加几滴溶液 |
假设3成立 |
已知:
| 药品名称 |
熔点/℃ |
沸点(℃) |
密度g/cm3 |
溶解性 |
| 正丁醇 |
-89.5 |
117.7 |
0.8098 |
微溶于水、溶于浓硫酸 |
| 1-溴丁烷 |
-112.4 |
101.6 |
1.2760 |
不溶于水和浓硫酸 |
根据题意完成下列填空:
(一)制备1-溴丁烷粗产品在如图装置的圆底烧瓶中依次加入NaBr,10 mL 正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。
(1)写出制备1-溴丁烷的化学反应方程式:__________________________________________________
(2)反应装置中加入沸石的目的是__________________。配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3)反应装置中,除了产物和水之外,还可能存在、等有机副产物。
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图装置蒸馏。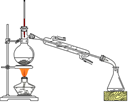
(5)收集产品时,控制的温度应在_________℃左右;区分1-溴丁烷精品和粗品的一种方法是____________________。
(6)实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为。(保留3位小数)。