CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下: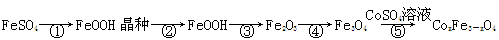
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为 ;
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是 ,吹入空气的作用为 。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的 (填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为 。
(5)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品。检验粗产品洗涤干净的实验操作和现象是 。
(6)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Co2+ |
6.9 |
9.4 |
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
② 。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④ 。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL |
应选用容量瓶的规格/mL |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为______________________。
(4)若注入容量瓶前未恢复到室温,对所配溶液浓度将有何影响? _______________(填“偏低”“偏高”“无影响”)
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是:
请你解释其中的原因_________________________________
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用化学方程式表示)__________________________
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液___________L才能与2.24 L氯气(标准状况)恰好完全反应。
(3)配制500 mL 4.0 mol·L-1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1 cm~2 cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切。
①所需称量的氢氧化钠固体的质量是__________________。
②上述步骤的正确操作顺序是________________________。
③上述实验需要的仪器有____________________________。
④某同学观察液面的情况如图所示,对所配溶液的物质的量浓度有何影响? _______________(填“偏高”、“偏低”或“无影响”);
⑤在配制溶液的过程中,下列操作能造成结果偏低的是___________。
| A.容量瓶不干燥,含有少量蒸馏水 |
| B.溶解所用烧杯未洗涤 |
| C.NaOH溶解后,未冷却即进行实验 |
| D.定容后摇匀,发现液面低于刻度线 |
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
| A.品红溶液 | B.紫色石蕊溶液 | C.酸性KMnO4溶液 | D.溴水 |
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
(5)下图是将过程②产生的气体SO2转化为重要的化工原料H2SO4的原理示意图,若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2SO4的质量比为___________________。
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=" Fe" +2Li2S,正极反应式是 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)  =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) =-392kJ/mol
=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
(1)写出装置A中发生反应的化学方程式: 。
(2)写出试剂Y的名称: 。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含氯元素的盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
| 步骤2:______________ |
|
| 步骤3:向B试管中滴加过量的稀HNO3溶液,再滴加AgNO3溶液。 |
若溶液变浑浊,结合步骤2中①,则假设1成立,结合步骤2中②,则假设2成立。 |
(4)已知C中有0.1mol Cl2参加反应。若假设l成立,可推知C中反应化学方程式为: