实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL |
应选用容量瓶的规格/mL |
| |
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为______________________。
(4)若注入容量瓶前未恢复到室温,对所配溶液浓度将有何影响? _______________(填“偏低”“偏高”“无影响”)
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为: 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.400 g。
步骤II将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
| 滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为___________。
如图所示,实验室用NH4Cl和Ca(OH)2制取NH3。试回答下列问题:
(1)写出反应的化学方程式
(2)B处的药品是
(3)检验D处试管中NH3是否收集满,除用湿红色石蕊试纸外,还可用方法是
。
(4)在标准状况下,收集到224mlNH3后,将它溶于水中,恰好得到100ml氨水,则最后所得溶液的物质的量浓度为mol/L
(8分)为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求填写下列空格: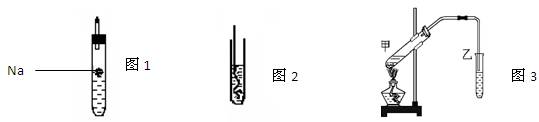
(1)如图1所示,试管中装乙醇产生的气体为;
(2)如图2所示,把加热的铜丝插入到装有乙醇的试管中,闻到有刺激性气味,该反应中产生的有机物为;
(3)用食醋浸泡有水垢(主要成分CaCO3)的水壶,可以清除水垢,说明醋酸的酸性碳酸的
酸性。(填“强于”或“弱于”)
(4)按如图3所示装置,甲试管中装有乙酸、乙醇、浓硫酸,则在装有饱和碳酸钠溶液的乙试管上方可闻到有特殊香味的物质,该物质为。
已知1,2-二氯乙烷常温下为无色液体,沸点为83.5 ℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置(加热装置略去)。
(1)如图所示,连接好仪器装置之后,首先需进行的操作是。
(2) 向装置A中大试管中加入1,2二氯乙烷和(写名称);并向装置C中试管里加入适量溴水。A中发生反应的化学方程式是 。
(3)与装置A中大试管相连接的长玻璃管除导气外的作用是 __________________,装置B的作用是 _________________。
(4)证明1,2 -二氯乙烷已发生消去反应的现象是_______________,还可通过什
-二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。
么实验加以验证:________________________________________。
甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛(HCHO)含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
原理:KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛。
离子方程式是:4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O 部分装置如下图所示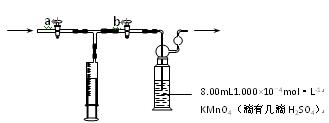
步骤:(1)配制1.000×10-4mol/L的KMnO4溶液:第一步:用分析天平称取KMnO4固体1.5800g,配成0.01mol/LKMnO4溶液,除了天平、药匙外,需要的玻璃仪器是:、、
、。第二步:用移液管量取上述已配制的溶液mL,再用上述用到的仪器配制1.000×10-4mol/L的KMnO4溶液。
(2)测定浓度
①用移液管量取8.00mL 1.000×10-4mol·L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②打开,关闭(填“a”或“b”),用注射器抽取100mL新装修的房屋室内空气。关闭,打开(填“ a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。重复到第5次注射器推至一半时KMnO4溶液刚好褪色(MnO4-→Mn2+)。
a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。重复到第5次注射器推至一半时KMnO4溶液刚好褪色(MnO4-→Mn2+)。
讨论:
(1)计算该居室内空气中甲醛的浓度mg·m-3,该居室的甲醛(填是或否)超标。
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,探究其可能的原因(假设溶液配制无错误)。
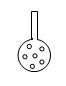
(3)实验结束后,该小组成员在相互交流的过程中一致认为:实验装置应加以改进:有同学提议,可将插入KMnO4溶液的管子下端改成具有多孔的球泡(右图),有利于提高实验的准确度,其理由是
 。
。