实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为: 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.400 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
| 滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为___________。
某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
⑴盛装0.2000 mol/L盐酸标准液应该用式滴定管。
⑵滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______________________________为止。
⑶ 滴定操作可分解为如下几步:
①检查滴定管是否漏水;②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器⑥滴定操作
正确的操作顺序为:。
⑷有关数据记录如下:
| 实验序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.70 |
| 2 |
20.00 |
6.00 |
26.00 |
| 3 |
20.00 |
1.40 |
21.20 |
则NaOH溶液的物质的量浓度为______________mol/L。
⑸若只用蒸馏水冲洗锥形瓶,则测定结果_________________;若滴定前平视读数,滴定终点时俯视读数,则会使所测酸的浓度值。(填“无影响”、“偏高”或“偏低”)。
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入少量铁屑,目的是;
(2)除去蒸馏水中溶解的O2常采用的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取 不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是。
不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是;
(2)在试管Ⅱ里加入的试剂是;
(3)这样生成的 Fe(OH)2沉淀能较长时间保持白色,其理由是(填字母);
A.H2将空气中的氧气反应消耗了。
B.试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,外界空气不容易进入。
(4)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______________________________________。
CO2和NaOH的反应是一个很基本的化学反应,有很多的实验方法可以通过观察到的明显现象说明CO2与NaOH溶液发生了反应.现提供如下实验用品:集气瓶、烧瓶、分液漏斗、长颈漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品.现有五位同学设计了如图所示的A~E五个装置,试回答: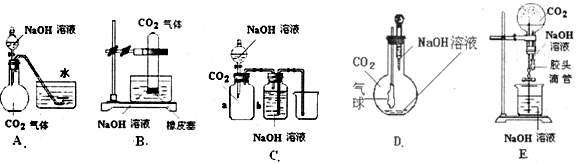
(1)对图A,当将分液漏斗中的NaOH溶液滴入烧瓶时,如果看到水槽中的水被吸入到烧瓶中,则证明CO2与NaOH溶液发生了反应.请写出此过程中NaOH溶液与CO2可能发生的反应离子方程式:__________________、____________________.
(2)对图B~E,请指出能达到实验目的的装置______________(用B、C、D、E填空).B中出现_______________________现象可证明CO2与NaOH发生了反应.
(3)将标准状况下一定体积的CO2气体缓慢通入V L NaOH溶液中,结果CO2和NaOH均无剩余.在反应后的溶液中加入足量的澄清石灰水得到W g沉淀.据以上数据能否确定CO2的体积?若能,请用上述数据求出CO2的体积.若不能,还需做什么实验?简要说明并运用实验测得的数据列式表示._________________________________________
为了测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取W g固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g
丙组:量取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。 消耗KMnO4溶液b mL。
消耗KMnO4溶液b mL。
(1)配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和。
(2)在丙组实验中滴定时是否需要选择指示剂?(填“需要”或“不需要”)。滴定终点的颜色变化是。
(3)用丙组的实验数据,计算Na2SO3的纯度。
(4)实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因。
为了证明有关物质的性质,某同学设计了如图所示的装置。当打开旋塞C,使A中液体与H中搁板上的固体B相遇时,即有气体产生,并发现D中的蜡烛慢慢熄灭;关闭C打开E时,则看到G中的蜡烛燃得更亮。请回答下列问题:
⑴请写出下列有关仪器的名称:AD
⑵请写出上图装置中有关仪器内盛放的物质的名称:A中,固体B,固体F
⑶用化学方程式表示F中发生的有关反应(用双线桥表示其中之一反应的电子转移方向和数目).
、
(4)、写出H中反应的离子方程式