已知:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是

A.升高温度能使 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
下列粒子与NH4+的质子总数和电子总数相同的是
| A.H3O+ | B.Ne | C.F- | D.NH2— |
下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是
| A.二氧化氮 | B.钠 | C.硫酸镁 | D.二氧化硅 |
甲、乙、丙、丁4种物质均为含有两种元素的化合物,其分子均含有18个电子,下列说法正确的是
| A.若气体甲的水溶液在常温下的pH<7,则甲一定是HCl |
| B.若气体乙的摩尔质量与O2相同,则乙一定是N2H4 |
| C.若3.0g丙的物质的量为0.1mol,则丙一定是甲烷的同系物 |
| D.若丁为四原子分子,则丁一定能使品红溶液褪色 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是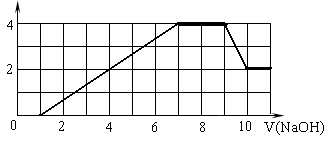
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42— 和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1 |
| D.反应最后形成的溶液中含有的溶质为Na2SO4 |
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
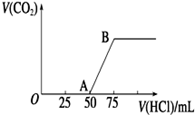
| A.OA段所发生反应的离子方程式:H++OH-==H2O;CO32- +H+ ==HCO3- |
| B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1 |
| C.产生的CO2体积(标准状况下)为0.056 L |
| D.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |