实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50—60 ℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是________________________。
(2)步骤③中,为了使反应在50—60 ℃下进行,常用的方法是________________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是____________。
(4)步骤④中粗产品用5% NaOH溶液洗涤的目的是_________________________________。
(5)纯硝基苯是无色,密度比水______ (填“大”或“小”),具有______气味的油状液体。
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。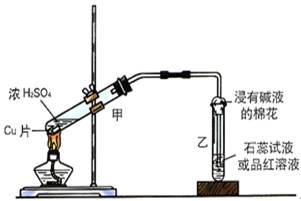
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成________________。
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成____________________。
写出甲装置中发生的主要反应的化学方程式________________________
(2)你在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请写出两种:____________________________________________________。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式。
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。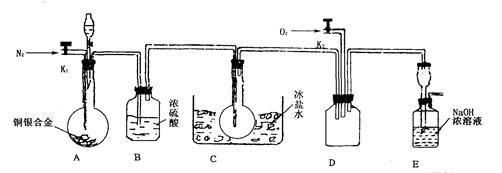
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是_____________________________________________________________。
(2)装置B瓶的作用是__________________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是__________________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程________________________。
把在空气中久置的铝片5.0 g投入盛有 500mL0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因___________,
有关反应的离子方程式为____________;
(2)曲线由a→b段产生氢气的速率较慢的原因___________
有关的化学方程式__________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答下列问题:
(1)装置A中发生的化学反应方程式为___________________________。
在此反应中,浓硫酸所体现的主要性质是______(填序号)
A酸性 B强氧化性 C脱水性 D吸水性 E强腐蚀性 F不挥发性
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_____________,其作用是_________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是。
B中应放置的液体是(填字母)__________________。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
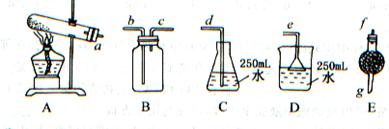
取wg含有杂质(杂质受热不分解)的NH4HCO3,选用如图所示的装置,制取一瓶干燥的氨气,多余氨气全部被水吸收。回答:
(1)选用的装置是(用A、B、C……回答),连接选取装置的正确顺序是(a,b,c……填写):接;接;接。
(2)E装置中所盛药品的名称是,其作用是。
(3)若选用B装置,连接时b口进气还是C口进气,其原因是。
(4)若收集到氨气VmL(标准状况),氨水的浓度为a mol/L,则碳酸氢铵的纯度为
%(设NH4HCO3全部分解)。