某同学用含硫酸亚铁等杂质的工业硫酸铜制取纯净的氧化铜以探究其性质。
(1)制备氧化铜
①将工业硫酸铜加适量水溶解、搅拌、过滤除去不溶性杂质。简述检验滤液中含有Fe2+的操作方法: 。
②向滤液中滴加H2O2溶液,稍加热,当Fe2+转化完全后,为将Fe3+全部转化为Fe(OH)3沉淀,而不会将Cu2+转化为沉淀,需慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5。加热煮沸后过滤,用稀硫酸酸化滤液至pH=1。再从溶液中分离出硫酸铜晶体。Fe2+转化为Fe3+的离子方程式是 。
③在测定所得硫酸铜晶体(CuSO4·xH2O)x值的实验中,所用的玻璃仪器名称为:酒精灯、
玻璃棒、 ,实验过程中称量操作至少进行 次。
④用得到的硫酸铜晶体制氧化铜。
(2)探究氧化铜的性质
在加热条件下,向下图所示装置中持续通入某纯净物X的蒸气,a处黑色物质变为红色,b处白色粉末变为蓝色,c处有无色液体产生。(设各步反应均进行完全)
则X可能是 (填一个化学式即可),X与CuO反应的化学方程式是
。
某研究性学习小组欲利用下列装置制取少量次氯酸钠,并进一步探究次氯酸钠的化学性质。
相关资料:反应Cl2+2NaOH=NaClO+NaCl+H2O属于放热反应,温度稍高时便发生副反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O。
(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。请在装置A、B、C中选择一个合适的装置放在②处:____________。
(2)部分学生认为上述装置存在缺点,他们指出在①②装置之间应增加如D所示的装置,你认为D中所盛液体是________,其作用是________________________________________。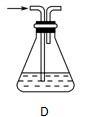
(3)该小组对产品的性质进行了如下探究。
第一步,测其pH=10。结合相关离子方程式解释原因:_________________________________________________________________。
第二步,该小组的同学选用了紫色石蕊试液对次氯酸钠的性质进行探究。请你帮助他们完成下表:
| 实验操作 |
预期现象 |
结论 |
某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
| 物质 |
颜色、性质 |
物质 |
颜色、性质 |
| 氢氧化铜Cu(OH)2 |
蓝色固体不溶于水 |
硫酸铜(CuSO4) |
溶液呈蓝色 |
| 氧化亚铜(Cu2O) |
红色固体不溶于水 |
氯化铜(CuCl2) |
浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) |
白色固体不溶于水 |
碱式氯化铜 |
绿色固体不溶于水 |
Ⅱ.探究实验:
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为__________________________。
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物,
①实验前,检查装置A气密性的方法是_______________________________。
②实验时,各装置从左至右的连接顺序为A→________→________→B→________→________。
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O________(填“是”或“否”),理由是________________________________________________________;
②装置________(填上图中装置编号)中________的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式___________________________ _。
(4)问题讨论
①电解CuCl2溶液后的阴极上发生的反应为:______________________
和_______________________________________________________________;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是__________________________________________________________。
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3·3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是_______________________________________。
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成NH3,写出反应的离子方程式:___________________________________
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(用离子方程式和简要文字表述):__________________________________________________________________
(4)某化学学习小组为定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100 mL,加入25 gFeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol·L-1 NaOH溶液、8.0 mol·L-1 NaOH溶液、澄清石灰水、0.01 mol·L-1 KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、小木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2;
假设2:气体是________________;
假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论。
| 实验步骤 |
预期现象与结论 |
| 将气体依次通入盛有________、________的洗气瓶中,________ |
__________________ |
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为________________。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验Ⅰ中收集到的气体点燃 |
能安静燃烧、产生淡蓝色火焰 |
①气体成分为________ |
| 实验Ⅲ |
②取实验Ⅰ中的白色不溶物,洗涤,加入足量________ |
③________________ __________________ __________________ |
白色不溶物可能含有MgCO3 |
| 实验Ⅳ |
取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 |
产生白色沉淀 |
④溶液中存在________ |
(3)为进一步确定实验Ⅰ的产物,设计定量实验方案,如图所示: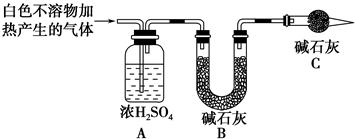
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式:__________________________ ______________________________________________。
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:____________________________________。
一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2:__________________。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为_________________________________。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。
按如图装置连接好仪器(暂不装入药品),___________________ ____。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹,_______________________________________________,
即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 |
预期现象和结论 |
(5)实验结论:铁与氧化铁反应的化学方程式为___________________________