资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为________________。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验Ⅰ中收集到的气体点燃 |
能安静燃烧、产生淡蓝色火焰 |
①气体成分为________ |
| 实验Ⅲ |
②取实验Ⅰ中的白色不溶物,洗涤,加入足量________ |
③________________ __________________ __________________ |
白色不溶物可能含有MgCO3 |
| 实验Ⅳ |
取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 |
产生白色沉淀 |
④溶液中存在________ |
(3)为进一步确定实验Ⅰ的产物,设计定量实验方案,如图所示: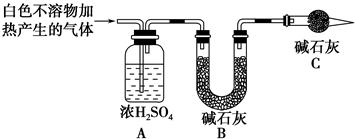
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式:__________________________ ______________________________________________。
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:____________________________________。
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ.实验装置如下图1所示
图1图2
(1)浓硝酸受热分解的化学方程式是 。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确),理由是。
Ⅱ.实验装置如上图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确”),理由是。
Ⅲ.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br‾,其目的为。
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
④C中液体产生颜色为。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是。
KMnO4溶液常用作氧化还原反应滴定的标准液其还原产物为Mn2+,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:
①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1 h;②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;③过滤得到KMnO4溶液并贮存;④利用氧化还原滴定方法,在70~80 ℃条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。
请回答下列问题:
(1)配制好的KMnO4溶液储存方法是。准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(2)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用________(填序号)。
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(3)若准确称取W g你选的基准试剂溶于水配成500 mL溶液,取25.00 mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。KMnO4溶液的物质的量浓度为________mol·L-1。滴定终点颜色变化为。
(4)若用放置两周的KMnO4标准溶液去测定水样中Fe2+的含量,测得的浓度值将________(填“偏高”、“偏低”或“无影响”)。原因是。KMnO4与Fe2+反应的离子方程式为。
红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式:。
(2)干燥管C内盛放的药品是和(填化学式)。干燥管的(填“m”或“n”)端与g导管相连接。
(3)在D处画出用试管收集氢气的装置图(所需其他仪器自行选择)。
(4)怎样用简单的方法检验收集到的气体是氢气,简述实验操作步骤和现象。
实验室要用98%(密度为1.84g.cm-3)的硫酸配制3.68mol/L的硫酸溶液480mL。
(1)需准确量取98%的硫酸mL。
(2)要配制3.68mol/L的硫酸溶液480mL,必须用到的仪器是烧杯、玻璃棒、量筒
(3)若配制3.68mol/L的硫酸溶液的其它操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是 。
| A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 |
| D.用胶头滴管向容量瓶中加水时,仰视观察溶液凹液面与容量瓶刻度相切 |
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?