下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属质量/g |
金属状态 |
c(H2SO4) / mol·L-1 |
V(H2SO4) / mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,____________对反应速率有影响,____________反应速率越快,能表明同一规律的实验还有____________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有____________(填实验序号)
(3)本实验中影响反应速率的其他因素还有________,其实验序号是____________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:_________________。
某小组以
、
、
、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体
。为测定其组成,进行如下实验。
①氨的测定:精确称取
,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%
溶液,通入水蒸气,将样品液中的氨全部蒸出,用
的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用
标准溶液滴定过剩的
,到终点时消耗
溶液。
②氯的测定:准确称取样品
,配成溶液后用
标准溶液滴定,
溶液为指示剂,至出现淡红色沉淀不再消失为终点(
为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是。
(2)用
标准溶液滴定过剩的
时,应使用式滴定管,可使用的指示剂为。
(3)样品中氨的质量分数表达式为。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将(填"偏高"或"偏低")。
(5)测定氯的过程中,使用棕色滴定管的原因是;滴定终点时,若溶液中
=2.0×10-5
,
为
。(已知:
=1.12×10-12)
(6)经测定,样品
中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为,制备
的化学方程式为;
的制备过程中温度不能过高的原因是。
是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备
•5
反应原理:
+

实验步骤:
①称取15
加入圆底烧瓶中,再加入80
蒸馏水。另取5
研细的硫粉,用3
乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出
•5
,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是。
(2)仪器
的名称是,其作用是。
(3)产品中除了有未反应的
外,最可能存在的无机杂质是,检验是否存在该杂质的方法是。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:。
II.测定产品纯度
准确称取
产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000
碘的标准溶液滴定。
反应原理为:2
+
=
+2
(5)滴定至终点时,溶液颜色的变化:。
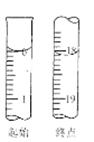
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为mL。产品的纯度为(设
•5
相对分子质量为
)。
III.
的应用
(7)
还原性较强,在溶液中易被
氧化成
,常用作脱氧剂,该反应的离子方程式为。
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(
)。
I.[查阅资料]
(1)
是无色透明晶体,易溶于水。其稀溶液与
溶液混合无沉淀生成。
(2)向
和
混合液中通入
可制得
,所得产品中常含有少量
,
。
(3)
易被氧化;
难溶于水,可溶于稀
。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)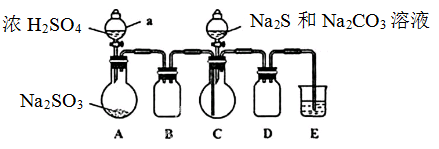
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是;
中的试剂是(选填下列字母编号)。
A.稀
B.
溶液 C.饱和
溶液
(2)先向
中烧瓶加入
和
混合溶液,再向
中烧瓶滴加浓
。
(3)待
和
完全消耗后,结束反应。过滤
中混合液,滤液经(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有
和
,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀
、稀
、稀
、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量
溶液,有白色沉淀生成,,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含
和
。
(2)为减少装置
中生成的
的量,在不改变原有装置的基础上对原有实验步骤
(2)进行了改进,改进后的操作是。
(3)
的溶解度随温度升高显著增大,所得产品通过方法提纯。
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要、(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为
、
]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为m,l。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
4)工业上用电石-乙炔法生产乙烯的反应如下:
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是、。
(5)乙烷和氯气反应可制得
,
加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
工业上用重铬酸钠(
)结晶后的母液(含少量杂质
)生产重铬酸钾(
),工艺流程及相关物质溶解度曲线如图: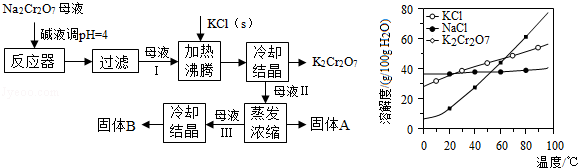
(1)由
生产
的化学方程式为,通过冷却结晶析出大量
的原因是.
(2)向
母液中加碱液调
的目的是 .
(3)固体
主要为(填化学式),固体
主要为(填化学式).
(4)用热水洗涤固体
,回收的洗涤液转移到母液(填"Ⅰ""Ⅱ"或"Ⅲ")中,既能提高产率又可使能耗最低.