是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备•5
反应原理:+
实验步骤:
①称取15加入圆底烧瓶中,再加入80蒸馏水。另取5研细的硫粉,用3乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出•5,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是
(2)仪器的名称是
(3)产品中除了有未反应的外,最可能存在的无机杂质是
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
II.测定产品纯度
准确称取产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 碘的标准溶液滴定。
反应原理为:2+=+2
(5)滴定至终点时,溶液颜色的变化:
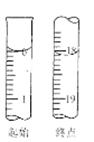
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为
III.的应用
(7)还原性较强,在溶液中易被氧化成,常用作脱氧剂,该反应的离子方程式为
下图是 教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去未画)。
教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去未画)。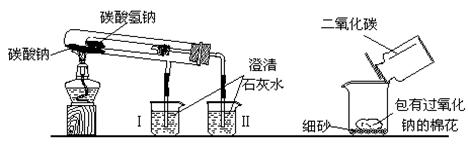
实验一实验二
回答下列问题:
⑴实验一的实验目的是,实验过程中可以看到烧杯中的实验现象是,加热过程中发生反应的化学方程式是: 。
。
⑵实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花燃烧。从该实验可以得出许多结论,请你写出由该实验得出的两个结论:
结论1:;
结论2:。
某化学兴趣小组用下图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。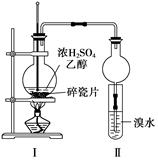
(1)写出该实验中生成乙烯的化学方程式:。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如下图装置,则A中的试剂应为,其作用是,B中的试剂为。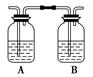
(5)处理上述实验后烧瓶中废液的正确方法是。
A.废液冷却后倒入下水道中
B.废液冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸
(本题有3小题)(共16分)
I. (6分)有下列物品或设备:①陶瓷餐具②砖瓦③水泥路桥④门窗玻璃⑤水晶镜片⑥石英钟表⑦玛瑙手镯⑧硅太阳能电池⑨光导纤维⑩计算机芯片
(1)用到硅单质的是_____________。(2)所用材料为SiO2或要用到SiO2的是__________________。(3)所用材料为硅酸盐的是_________________。
II.(6分)如图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,请填写下列空白: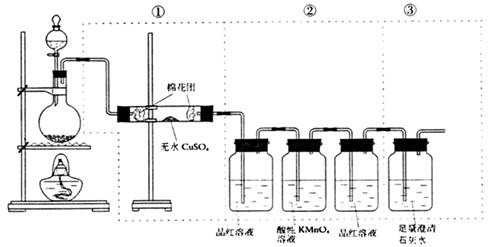
装置中①检出的物质是_______,②的作用是,
③可以证明生成物有;浓硫酸与木炭粉在加热条件下反应的化学方程式是:_____________。
III.利用下图所示的装置收集以下6种气体:
①CO2、②C12、③NO2、④SO2、⑤NH3、⑥NO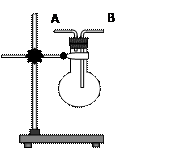
(1)若烧瓶是干燥的,由B口进气,可收集的气体有,
(2)若在烧瓶内充满水,收集NO气体,则气体应由口进入。
Ⅰ.下列有关实验的叙述,正确的是________(填字母序号)。
A.配制0.1 mol/L的氯化钠溶液时,将称量的氯化钠固体直接加入容量瓶,再加水至刻度线。
B.用洁净且干燥的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上,与标准比色卡对照,测溶液的pH。
C.滴定管洗净后,经蒸馏水润洗后可注入标准液进行滴定。
D.向20 mL煮沸的蒸馏水中滴加FeCl3饱和溶液1~2 mL,继续煮沸,待溶液呈红褐色即得Fe(OH)3胶体。
E.用浓氨水洗涤做过银镜反应的试管。
F.制备乙酸乙酯时,药品加入顺序为:乙醇——浓硫酸——乙酸。
G.当不慎在皮肤上沾上浓硫酸时,应立即用大量水冲洗。
Ⅱ.如下图所示仪器和装置,经过简单的连接,可制取多种中学化学常见的气体(不考虑尾气吸收)。请回答下列问题:
(1)选择装置A、D可制取的气体是________________(仅填一种气体的化学式即可);反应的化学方程式为:________________。
(2)选择装置________(填写装置的字母)可制取乙烯,检验乙烯中还原性杂质气体应选择的试剂是________。
(3)选择装置C、F,可制取的气体是________(仅填一种气体的化学式即可);检查装置C气密性的方法是:_______ .
(10分)动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
||||
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
|
||||
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
||||
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。仪器:① ,② ,试管,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应实验现象的编号和②的化学方程式及此实验的结论)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
① ,
② ,
此实验的结论: 。