为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如下图所示。

请回答以下问题:
(1)测量氢气体积的正确装置是___________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是___________(填写编号)。
A.防止无水酒精挥发 B.保证实验装置不漏气 C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是____________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,量取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为___________,由此可确定乙醇的结构式为___________,而不是______________________。
(5)实验所测定的结果偏高,可能引起的原因是______________________(填写编号)。
A.本实验在室温下进行 B.无水酒精中混有微量甲醇 C.无水酒精与钠的反应不够完全
如下图是实验室制备SO2并验证SO2某些性质的装置图。试回答: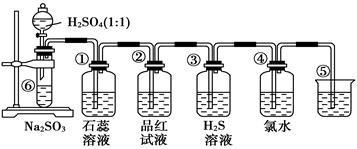
(1)⑥中发生的化学反应方程式为_____________________________。
(2)②中实验现象是,③中反应产物的化学式是
(3)⑤的作用是_____________________,反应的离子方程式为___________________。
为测定氯化亚铁和氯化铁的混合物中铁元素的质量分数,某研究小组设计了如下两种实验流程:
(1)操作Ⅱ、Ⅲ是否完全相同?________(填“是”或“否”);操作Ⅳ使用的一种主要硅酸盐材料的仪器名称是________。
(2)甲方案中沉淀A是_______(填化学式);如何判断沉淀A洗涤干净? ________________________________________________________________________。
(3)乙方案中能否用铁粉做还原剂,请用文字说明理由____________________________。
(4)写出乙方案中滴入KMnO4溶液后发生反应的离子方程式_______________________。
(5)若甲方案中红棕色固体质量为bg,乙方案滴定时消耗c mol·L-1 KMnO4溶液dmL,哪个方案测定出来的铁元素含量更准确?_______(填“甲方案”或“乙方案”);据此方案测出的铁元素的质量分数为_______(用字母表示)。
实验室采用
、A
的混合溶液与过量氨水反应制备
,主要流程如下:
(1)为使
、
同时生成沉淀,应先向沉淀反应器中加入(填"
"或"
"),再滴加另一反应物.
(2)如下图所示,过滤操作中的一处错误是.
(3)判断流程中沉淀是否洗净所用的试剂是.高温焙烧时,用于盛放固体的仪器名称是.
(4)无水
(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
装置
中盛放饱和
溶液,该装置的主要作用是.
中试剂的作用是.用一件仪器装填适当试剂后也可起到
和
的作用,所装填的试剂为.
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: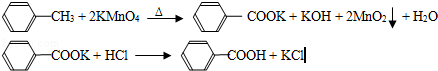
实验方法:一定量的甲苯和
溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.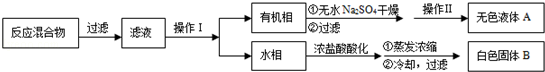
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3
和6.9
;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为,操作Ⅱ为.
(2)无色液体
是,定性检验
的试剂是,现象是
(3)测定白色固体
的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与
的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
将白色固体 加入水中,加热溶解, | 得到白色晶体和无色溶液 |
|
| ② |
取少量滤液于试管中, | 生成白色沉淀 |
滤液含 |
| ③ |
干燥白色晶体, | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 产品,配成100 甲醇溶液,移取25.00 溶液,滴定,消耗 的物质的量为2.40×10﹣3 ,产品中苯甲酸质量分数的计算表达式为,计算结果为(保留二位有效数字).
碘在科研与生活中有重要作用,某兴趣小组用
、0.2%淀粉溶液、
、
等试剂,探究反应条件对化学反应速率的影响.
已知:
(慢)
(快)
(1)向
、
与淀粉的混合溶液中加入一定量的
溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,
与
初始的物质的量需满足的关系为:n(
):n(
).
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 |
体积V/ml |
||||
|
溶液 |
水 |
溶液 |
溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中Vx=ml,理由是.
(3)已知某条件下,浓度c(
)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(
)~反应时间t的变化曲线示意图(进行相应的标注).
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:
已知:
则电池反应的
=;碘电极作为该电池的极.