摄影胶卷上涂的感光材料主要是AgBr。在照相时按动快门的一瞬间,进入相机的光使AgBr发生了分解反应 。由于进光量极少,分解出的Ag极少,所以必须通过化学方法进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
。由于进光量极少,分解出的Ag极少,所以必须通过化学方法进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
(1)曝光时所产生的微量Ag在显影过程中________。
A.是氧化剂 B.是还原剂
C.起催化剂的作用 D.不起什么作用
(2)显影液中如果只溶有对苯二酚,显影速度则非常缓慢。为提高显影速度,可加入_________。
A.Na2SO4 B.Na2SO3 C.Na2CO3 D.Na2S2O3
(3)溶于显影液中的氧气能与对苯二酚反应,最终生成棕褐色的污斑,影响底片的质量。
为避免形成污斑,可向显影液中加入__________。
A.Na2SO4 B.Na2SO3 C.Na2CO3 D.Na2S2O3
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 _______________________.
(2)称取铁钉6.0g放入15.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除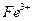 外还可能含有
外还可能含有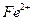 ;若要确认其中含有
;若要确认其中含有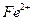 ,应首先用_________
,应首先用_________
进行检验(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.氨水 d.酸性 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
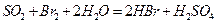 ;然后加入足量
;然后加入足量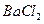 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中 的体积分数为 _____。
的体积分数为 _____。
[探究二]分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有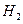 和Q气体。
和Q气体。 为此设计了下列探究实验状置(图中夹持仪器省略)。
为此设计了下列探究实验状置(图中夹持仪器省略)。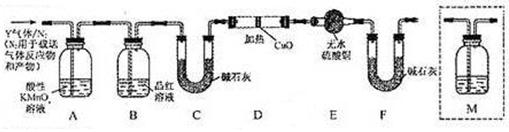
(3)装置B中试剂的作用是 __________________________;
(4)为确认Q的存在,需在装置中添加M于(选填序号)。
| A.A之前 | B.A-B间 | C.B-C间 | D.C-D间 |
(5)如果气体Y中含有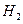 ,预计实验现象应是 ______________________
,预计实验现象应是 ______________________
____________________________
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中,试剂①最佳为(填代号),检验溶液A中Fe3+的最佳试剂为(填代号)。
a.KMnO4b.(NH4)2S c.H2O2 d.KSCN[
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为。加入CuO作用是 ____________________________________。
(2)由溶液C获得CuSO4·5H2O,需要经过一系列操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入)(填化学式)。
写出该反应的化学方程式 __________________________。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液
应用______________(填写仪器名称);取A溶液稀释一定倍数后,用KM nO4标
nO4标
准溶液滴定,终点现象为。
Br2和Fe3+ 的水溶液浓度较小时均呈现黄色,二者都具有较强的氧化性。某化学兴趣小组拟通过探究实验来比较二者氧化性的强弱。
实验操作:向足量的硫酸亚铁溶液中加入少量浓溴水,振荡。
实验现象:溶液由浅绿色变为黄色。
(1)提出假设:
甲同学认为氧化性:Br2 >Fe3+ ,则反应的离子方程式为;
乙同学认为氧化性:Fe3+ >Br2 ,则使溶液呈黄色的物质是(填化学式)。
(2)通过进一步实验可以检验甲和乙的结论谁对谁错,下列是设计的一些实验方案和预测:
| 方案 |
实验操作 |
预期现象及结论 |
| 1 |
取少量黄色溶液,加入NaOH溶液 |
若生成红褐色沉淀,则甲正确 |
| 2 |
取少量黄色溶液,加入淀粉KI溶液 |
若溶液变蓝色,则乙正确 |
| 3 |
取少量黄色溶液,加入苯溶液,振荡后静置 |
若上层溶液呈橙红色,则正确 |
①方案1是否合理(填“是”或“否”)。
②方案2中,由于存在反应 (用离子方程式表示),
(用离子方程式表示),
所以预测结论不正确。
③请另外设计一个合理方案,证明已经发生反应。将有关内容填入下表。
| 实验操作 |
预期现象及结论 |
用中和滴定法测定烧碱的纯度,已知烧碱中杂质不与酸反应,试根据要求填空:
(1)配置待测液:称取5.0g烧碱样品,配成250mL待测溶液;
(2)滴定:用0.2000 mol·L-1标准盐酸溶液滴定待测溶液,下面的操作错误的有 。
。
①用标准盐酸溶液润洗酸式滴定管;
②用待测烧碱溶液润洗锥形瓶;
③两个同学合作,一人控制酸式滴定管的活塞,另一人摇动锥形瓶;
④滴定过程中,操作者的眼睛始终注视酸式滴定管液面的变化。
(3)根据下表数据计算:
①待测烧碱溶液的物质的量浓度: (结果保留4位有效数字);
(结果保留4位有效数字);
②烧碱的纯度:。
| 滴定次数 |
待测溶液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读 数(mL) 数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.45 |
| 第二次 |
10.00 |
4.00 |
24.05 |
17.某同学配置100 ml浓度为1 mol·L-1的Na2CO3溶液,并进行有关实验,请回答下列问题:
(1)需要称量碳酸钠的质量为 ▲g
(2)配置该碳酸钠溶液 时使用的仪器除天平、烧杯、胶头滴管外,还必须用到的玻璃仪器有▲ 、 ▲。
时使用的仪器除天平、烧杯、胶头滴管外,还必须用到的玻璃仪器有▲ 、 ▲。
(3)在操作过程中,该同学转移液体后未经洗涤烧 杯就加水定容至刻度线,则所配置溶液的浓度将
杯就加水定容至刻度线,则所配置溶液的浓度将
▲ (填“偏大”、“偏小”、或“不变”)
(4)在定容这一操作中,应在距刻度线 ▲ 处,改用胶头滴管滴加蒸馏水至容量瓶内液体的▲ 与刻度线保持水平。