用中和滴定法测定烧碱的纯度,已知烧碱中杂质不与酸反应,试根据要求填空:
(1)配置待测液:称取5.0g烧碱样品,配成250mL待测溶液;
(2)滴定:用0.2000 mol·L-1标准盐酸溶液滴定待测溶液,下面的操作错误的有  。
。
①用标准盐酸溶液润洗酸式滴定管;
②用待测烧碱溶液润洗锥形瓶;
③两个同学合作,一人控制酸式滴定管的活塞,另一人摇动锥形瓶;
④滴定过程中,操作者的眼睛始终注视酸式滴定管液面的变化。
(3)根据下表数据计算:
①待测烧碱溶液的物质的量浓度:  (结果保留4位有效数字);
(结果保留4位有效数字);
②烧碱的纯度: 。
| 滴定次数 |
待测溶液 体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读 数(mL) 数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.45 |
| 第二次 |
10.00 |
4.00 |
24.05 |
化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。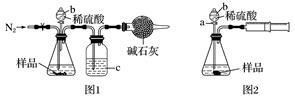
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是 。实验开始前,打开止水夹,先通入N2,,通入N2的作用是_______________________________;一会后,连接上干燥管,打开b的活塞,滴下稀硫酸,充分反应后,再通入N2的目的 。
(2)乙同学用图2所示装置,取一定质量的样品(m g)和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的__________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验: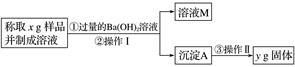
①操作Ⅰ涉及的实验名称有__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。
②丙同学测得的样品中Na2CO3质量分数的计算式为__________。
Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为________________________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。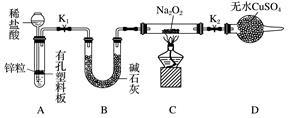
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________________。
③设置装置D的目的是________________________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。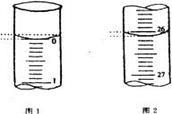
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|||
| 第二次 |
25.00 |
2.00 |
28.08 |
26.08 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
维生素C也称为抗坏血酸,是一种无色晶体,其水溶液显酸性,其化学特性是易失去电子,在水溶液中或受热时易被氧化。
[实验探究]
| 实验内容 |
实验现象 |
| 向2mL维生素C溶液中滴加2滴紫色石蕊溶液 |
溶液变为 色 |
| 将维生素C的溶液逐渐加入到2mL溶有淀粉的碘水中 |
溶液由蓝色变为无色 |
[问题思考]
①生的新鲜蔬菜比炊熟的蔬菜所含维生素C (填“高”或“低”)。
②维生素C可使食物中的Fe3+转化为Fe2+,这一过程体现了维生素C的 (填“氧化性”或“还原性”)。
③医生建议坏血病患者应多吃的食物是 (任举一种)。
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
(1)指出提取的过程中有关实验操作名称:① ;③ 。
(2)提取碘的过程中,可供选择的有机溶剂是 。(填字母序号)
A. 水、酒精 B. 四氯化碳、苯 C. 汽油、酒精
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,实验装置如图所示。
仪器A的名称为: 。指出装置
中的错误之处;① ;
② ;③ 。