某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围 (PH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
(1)该实验应选用______________作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是______________
(2)下图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为______________ ml。此时滴定管中液体的体积______________。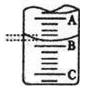
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/ml |
26.02 |
25.32 |
25.28 |
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能是______________
| A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积 |
| B.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗 |
| D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗 |
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):______________
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
CoCl2•6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图: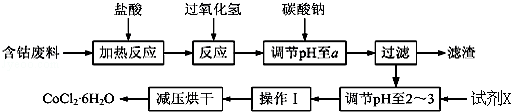
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3
开始沉淀 2.3 7.5 7.6 3.4
完全沉淀 4.1 9.7 9.2 5.2
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 (写一点).
(2)加入碳酸钠调节pH至a,a的范围是 ;pH调至 ,a后过滤,再用试剂X将滤液的pH调节至2﹣3,则所用的试剂X为 .
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是 .
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是 .
(6)在实验室中,为了从上述产品中获得纯净的CoCl2•6H2O,常将制得的产品溶解于乙醚中,然后 、 (填实验操作)获得纯净的CoCl2•6H2O
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图: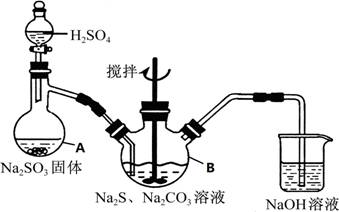
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称 ,步骤④中洗涤时,为了减少产物的损失的试剂可以是
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论
(4)测定产品纯度
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000mol•L﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为 mL,产品的纯度为 %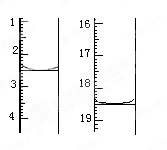
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为 .
(10分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。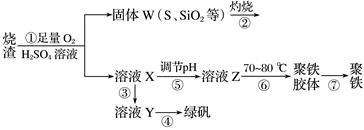
(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是________(填字母)。
A.品红溶液 B.紫色石蕊溶液
C.酸性KMnO4溶液D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为__________________。
(3)过程③中需加入的物质是________________。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要________________。
(5)过程⑤调节pH可选用下列试剂中的________(填字母)。
A.稀硫酸B.CaCO3C.NaOH溶液
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。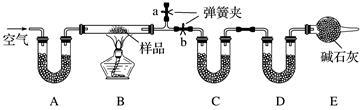
(1)加热前通入空气的目的是_______________,操作方法为___________________。
(2)装置A、C、D中盛放的试剂分别为A___________,C_____________,D______________。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将________(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将________;若撤去E装置,则测得Na2CO3·10H2O的含量将________。
(4)若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中NaHCO3的质量分数为______________(用含w、m1、m2的代数式表示)。
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。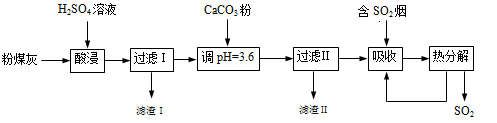
(1)酸浸时反应的化学方程式为 ;滤渣Ⅰ的主要成分为 (填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为 (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是 (用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是 ;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。