(10分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。
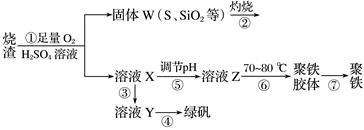
(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是________(填字母)。
A.品红溶液 B.紫色石蕊溶液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为__________________。
(3)过程③中需加入的物质是________________。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要________________。
(5)过程⑤调节pH可选用下列试剂中的________(填字母)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
如下图所示,室温下向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2(所有气体体积均在标准状下测定)。
试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①_______________________________;
②_______________________________;
③_______________________________。
(2)最终试管中剩余的气体是_________,体积为_________。
漂白粉可以和浓盐酸反应产生氯气,某课外兴趣小组试图测定氯气的体积并验证纯净干燥的氯气没有漂白性,现用如图所示装置进行实验,请回答有关问题: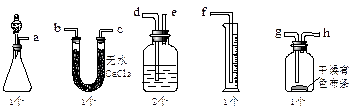
(1)该装置的正确连接顺序是:a接( )、( )接( )、( )接( )、( )接( )、( )接( )。
(2)U型管可以用( )替代(填装置名称),内盛装的试剂是( )。
(3)洗气瓶中的液体是( )。
(4)在制取氯气前,必须进行的一项操作步骤是( )。
(5)按照实验目的进行之后,干燥有色布条是否褪色( )(填是或否)。
(6)该兴趣小组在实验中,发现量筒中并没有收集到液体,你认为他们失败的原因可能是什么?
如图所示,试管中集满干燥的氯气,胶头滴管中装有供反应的足量浓氨水。滴入浓氨水,开始时试管内发生的反应有氧化还原反应:NH3+Cl2→N2+HCl并产生红光和白烟。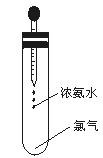
请根据以上反应和现象回答下列问题:
(1)标志反应全部完成的现象是。
(2)反应完毕后,将试管浸入水中并倒立着试管,取下滴管,有水进入试管.在室温时,进入试管内的水约占试管容积的。
(3)反应中生成的白烟是。
(4)用写出试管中反应的化学方程式。
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。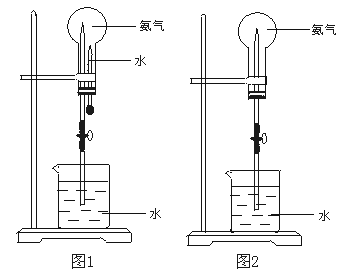
(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法,要得到干燥的氨气可选用作干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是,该实验的原理是。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气,请用下图所示装置设计一个实验,以确认上述混合气中含有CO和H2。
(1)连接上述装置的正确顺序是:(填接口字母)混合气→( ),( )接( ),( )接( ),( )接( ),( )接( ),( ).
(2)确认混合气中含有H2的实验现象是__________,其理由是_________________。