如图所示,横坐标表示通入气体或加入试剂的体积,纵坐标表示产生沉淀的物质的量。适合下列各种情况的分别填入该题后(填图的字母代码)。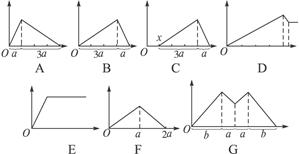
(1)向石灰水中通入二氧化碳_________。
(2)向氯化铝溶液中滴入NaOH溶液_________。
(3)向偏铝酸钠溶液中加入稀盐酸_________。
(4)向盐酸和氯化铝混合溶液中逐滴加入氢氧化钠溶液_________。
(5)向MgCl2和AlCl3混合液中加入过量的NaOH溶液_________。
(6)向MgCl2和AlCl3混合液中先加NaOH溶液后,至沉淀不再溶解,加HCl溶液_________。
(7)向AlCl3溶液中加氨水_________。
(8)向NaAlO2溶液中通入CO2气体_________。
(9)向KAl(SO4)2中滴加Ba(OH)2_________。
(10)向Al2(SO4)3中滴加NaAlO2溶液_________。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL 稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀 H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。 |
| B.用待测的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写):。
②该滴定操作中应选用的指示剂是:。
③在G操作中如何确定终点?。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为mol/L (计算结果保留两位小数)
(14分)某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
III.按如图所示装置连接仪器、检查气密性、装入化学试剂。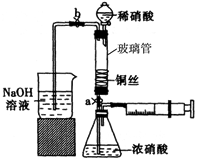
(1)过程I发生反应的离子方程式是。
(2)写出过程III中检查气密性的方法。
(3)过程III的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是,一段时间后使反应停止的操作是,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目是,该反应的离子方程式是。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):
| 实验编号 |
水温/℃ |
液面上升高度 |
| 1 |
25 |
超过试管的2/3 |
| 2 |
50 |
不足试管的2/3 |
| 3 |
0 |
液面上升超过实验1 |
①根据上表得出的结论是温度越(填“高”或“低”),进入试管中的溶液越多。
②查阅资料:a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2 3HNO2 =HNO3+2NO+H2O;
b.HNO2不稳定。
则产生上述现象的原因是。
(7分)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。请完成下列填空:
取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验 编号 |
NaOH溶液的浓度 (mol·L-1) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸的体积(mL) |
| 1 |
0.10 |
22.50 |
20.00 |
| 2 |
0.10 |
25.80 |
20.00 |
| 3 |
0.10 |
22.62 |
20.00 |
(1)滴定达到终点的标志是。
(2)根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______(填选项字母)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图中Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___________________。
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)_______;
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管A中装入的固体最好是(填化学式)________。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为_________________________;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为______,请设计实验检验所得溶液中溶质的阴离子___________。
某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液备用。
(1)该同学应选择的玻璃仪器除了烧杯、量筒、玻璃棒、胶头滴管外,还有。
(2)其操作步骤如下图所示,则如图操作应在下图中的(填选项字母)之间。
| A.②与③ | B.①与② | C.④与⑤ | D.③与④ |

(3)该同学应用托盘天平称取NaOH固体g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。
(4)下列操作对所配溶液浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,仰视读数,浓度会;
②转移溶液过程中,未洗涤玻璃棒和烧杯,浓度会;
③容量瓶未干燥,浓度会;
④定容摇匀后发现溶液凹面低于刻度线,继续加水至刻度线,浓度会。
(5)配制溶液的实际操作过程中,动作要快,否则由于,会使配制的NaOH溶液的浓度比1 mol·L-1______(填“大”或“小”)。