碱式硫酸铁[Fe(OH)SO4]可用作净水剂、媒染剂、颜料和药物。工业上利用废铁屑(含少量氧化铝、氧化铁等),生产碱式硫酸铁的部分工艺如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)反应I中发生的氧化还原反应的离子方程式是__________。
(2)反应II中加入NaHCO3调节体系的pH在____范围内。
(3)反应III中生成的气体遇空气变红棕色,则III中发生反应的离子方程式是_________ 。
(4)反应III中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=____mol。
(5)用硫酸可知体系的pH。若硫酸加入量过小,溶液生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是_________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可发生水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式是____________。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)。
| Fe3+ |
Fe2+ |
Zn2+ |
|
| 开始沉淀的pH |
1.1 |
5.8 |
5.9 |
| 沉淀完全的pH |
3.0 |
8.8 |
8.9 |
请回答下列问题:
(1)由不溶物E生成溶液D的离子方程式为______________________________。
(2)加入ZnO调节pH=a的目的是___________________,a的范围是 。
(3)检验滤液D中不存在铁离子的实验操作是 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是______。
A.ZnOB.NaOH C.Na2CO3D.ZnSO4
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2,I2+2S2O32-=2I-+S4O62-。
①胆矾晶体的纯度为_________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会________(填“偏高”、“偏低”或“不变”)。
[实验化学]苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下: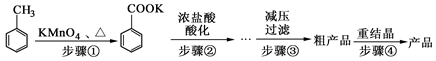
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
在水中溶解性 |
| 甲苯 |
-95 |
110.6 |
0.8669 |
难溶 |
| 苯甲酸钾 |
121.5~123.5 |
 |
 |
易溶 |
| 苯甲酸 |
122.4 |
248 |
1.2659 |
微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 (填“上”或“下”)层;实验操作的名称是 。
(2)步骤②用浓盐酸酸化的目的是 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 。
(5)重结晶时需要趁热过滤,目的是 。
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下: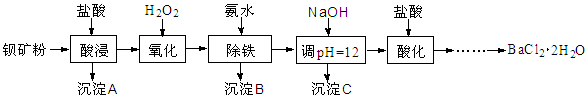
(1)酸浸反应的主要离子方程式为 。
(2)沉淀B主要成分为 ;沉淀C的主要成分是Ca(OH)2和Mg(OH)2。
由图可知,为了更好的使Ca2+沉淀,还应采取的措施为 。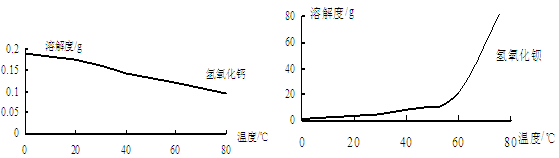
(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3: ,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于 中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为 。
②步骤5所用瓷质仪器名称为 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为 。
③有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因 。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
某化学探究小组拟用废铜屑制取Cu(NO3)2,并探究其化学性质。
I.如图,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液。
(1)写出铜与浓硝酸反应的离子方程式 。
(2)①装置中NaOH溶液的作用是 。
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、 、过滤。
③你认为此装置是否合理,并说明原因 。
如果不合理,同时在原装置上改进;如果合理,只需说明原因。
Ⅱ.为了探究Cu(NO3)2的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体。
【解释与结论】
(3)①红棕色气体是 。
②根据现象判断Cu(NO3)2在加热条件下可以分解,其化学反应方程式为 。
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3·Cu(OH)2]。
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品。
【实验数据】反应温度对样品的影响
| 实验序号 |
1 |
2 |
3 |
4 |
| 温度/℃ |
35 |
50 |
70 |
95 |
| 样品颜色 |
深蓝色 |
深蓝色 |
浅绿色 |
暗蓝色 |
| 样品中碱式碳酸铜 的质量分数/% |
90.9 |
92.7 |
x |
92.0 |
(4)滤液中可能含有CO32—,写出检验CO32—的方法 。
(5)95℃时,样品颜色发暗的原因:____ 。
(6)70C时,实验得到2.38 g样品,取此样品加热至分解完全(杂质不分解),得到1.76 g固体,此样品中碱式碳酸铜的质量分数是 。
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂。其部分工业流程如下:
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
②某些物质的溶解度(S)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3部分的流程如下图所示,括号表示加入的试剂,方框表示所得的物质。则步骤Ⅱ中反应的离子方程式是______________________________。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_____________________________。
(3)最后一个步骤中,用“热水洗涤”的目的是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________。
②电解后,LiOH溶液浓度增大的原因_____,b中,生成Li2CO3反应的化学方程式是_______。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。