以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下:
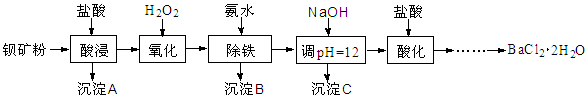
(1)酸浸反应的主要离子方程式为 。
(2)沉淀B主要成分为 ;沉淀C的主要成分是Ca(OH)2和Mg(OH)2。
由图可知,为了更好的使Ca2+沉淀,还应采取的措施为 。
(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3: ,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于 中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为 。
②步骤5所用瓷质仪器名称为 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为 。
③有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因 。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
(14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式:、。
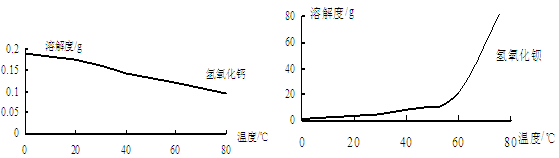
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是 。
② TiO2+水解的离子方程式为。
向溶液II中加入Na2CO3粉末的作用是。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于℃即可。
| TiCl4 |
Mg |
MgCl2 |
Ti |
|
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(4)电解TiO2制备钛的方法如图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为。
【化学—选修2:化学与技术】
生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。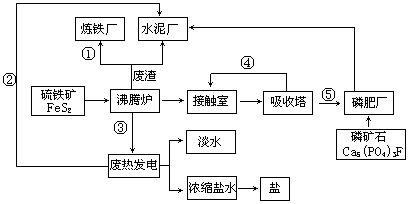
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在( )
| A.西部山区 | B.沿海地区 | C.发达城市 | D.东北内陆 |
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸腾炉发生反应的化学方程式 ,磷肥厂的产品是普钙,其主要成份是 (填化学式)。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想 , (请写出两点)。
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
| 编号 |
操作 |
现象 |
| I |
先向2 mL 0.1 mol/L FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 |
|
| II |
先向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 |
滴加KSCN溶液后,溶液变成红色;滴加KI溶液后,红色无明显变化 |
①实验I的现象为。
②FeCl2溶液与新制氯水反应的离子方程式为。
(2)该同学分析了导致实验II现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
| 编号 |
操作 |
现象 |
| III |
向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液,再滴加KSCN溶液 |
滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成红色 |
根据实验III,甲同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由。
(3)该同学认为需要进一步设计实验证明根据实验III中现象得出的结论。请补全下表中的实验方案。
| 编号 |
操作 |
预期现象及结论 |
| IV |
向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液, |
现象: 结论: |
(4)上述实验结果表明,Fe3+确实与I-发生氧化还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验III中加入KSCN后溶液变红的原因,认为Fe3+与I-反应的离子方程式应写为
。
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g)△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是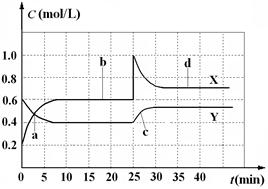
| A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
| D.若要达到与d相同的状态,在25 min时还可以采取的措施是适当缩小容器体积 |
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。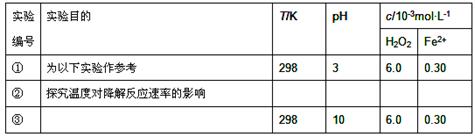
[数据处理]实验测得p-CP的浓度随时间变化的关系如图。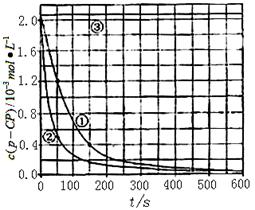
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率: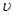 (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度 过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(4)实验③得出的结论是:pH等于10时,。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:。