(6分)从 、
、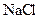 、
、 、
、 、
、 五种物质中:
五种物质中:
(1)选取溶于水中会促进水电离,且溶液显碱性的物质,用离子方程式表示溶液其显碱性的原因:
;
(2)选取溶于水会抑制水电离,且溶液显酸性的物质,用化学用语表示其显酸性的原因:
;
(3)选取溶于水会促进水电离,且溶液显酸性的物质,用离子方程式表示溶液其显酸性的原因:
。
①14N②金刚石③14C④乙醇(CH3CH2OH)⑤13C⑥二甲醚(CH3OCH3)
(1)和互为同位素(填序号)
(2)和的质量数相同,质子数不同。(填序号)
(3)④和⑥互为。
(4)②金刚石属于晶体,熔化时需要克服微粒间的作用力是。
A、B、C、D、E是位于短周期的主族元素。已知:
①热稳定性:HmD>HmC;
②Cm-、E(m-1)-具有相同的电子层结构;
③A、B与C在同一周期,在该周期元素中,A的原子半径最大,B的离子半径最小;
④A与B质子数之和是D质子数的3倍。
依据上述信息用相应的化学用语回答下列问题:
考查原子核外电子的排布规律及元素周期律等。
(1)HmDm的电子式为
(2)Cm-、E(m-1)-的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)B单质与A的最高价氧化物对应水化物反应的化学方程式为:______________________。
(4)常温下,将CDm通入HmC溶液中,有C析出,写出该过程的化学方程式。
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。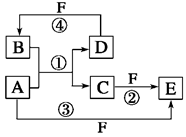
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A 是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A原子的结构示意图为,反应④的化学方程式为_______________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①和②均在水溶液中进行,写出反应②的离子方程式_________,E与A再生成C的离子方程式是。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为___________________________________。
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为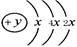 ;B、C可形成离子化合物B3C2,
;B、C可形成离子化合物B3C2,
据此利用相应的化学用语填空:
(1)A元素在周期表中的位置是,其气态氢化物的化学式为。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为。
(3)B和C最高价氧化物对应水化物的化学式分别为和。
下列七种物质中 Ne O2 H2O NH3 H2SO4 KOH MgCl2
只含有共价键的是,只含有离子键的是,既含有离子键又含有共价键的
是属于共价化合物的是,属于电解质的是。(填化学式)