(8分)下列三种有机物都是某些植物挥发油中的主要成分。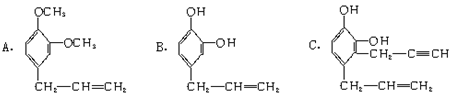
回答下列问题:
(1)这三种有机物均属于(选填字母)_____________。
a.芳香烃 b.酚类 c.芳香族化合物 d.不饱和烃类
(2)一定质量的有机物C,在足量O2中完全燃烧,生成CO2和消耗O2的物质的量之比为_____________。
(3)A能发生的反应类型(选填字母)_____________。
a.消去反应 b.与NaOH溶液中和 c.加成反应
d.氧化反应 e.加聚反应 f.还原反应
(4)A分子有多种同分异构体,其中均含有两个“-OCH3”和一个“-CH2-CH=CH2”基团的芳香族化合物除A外还有五种,请写出其余任意两种的结构简式:
____________________________________________________________________。
可逆反应:aA(g) + bB(g) 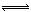 cC(g) + dD(g) ΔH=Q;根据图回答:
cC(g) + dD(g) ΔH=Q;根据图回答:
①压强 P1比P2填(大或小)
② (a +b)比(c +d) 填(大或小)
③温度t1℃比t2℃(高或低)
④ Q值为填(正或负)(正值表示正反应吸热,负值表示正反应放热)
(19分)从樟科植物枝叶提取的精油中含有甲、乙两种成分: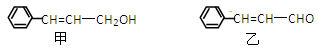
(1) ①甲和乙中含氧官能团的名称分别为和。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2) 由甲转化为乙的过程为(已略去无关产物):
写出有关反应的化学方程式:
(3) 反应I的反应类型为,1mol甲最多可与mol H2发生加成反应。
某一无色透明溶液A,焰色反应呈黄色。当向溶液中通入二氧化碳时则得到浑浊液B,B加热到70OC左右,浑浊液变澄清。此时向溶液中加入少量的饱和溴水,立即有白色沉淀C产生。分别写出A、B、C的名称和结构简式:
A:;B:;C:。
完成有关反应的化学方程式:
按顺序写出实现下列转化的化学方程式
CH3CH2Br → CH3CH2OH→CH2==CH2 →CH2BrCH2Br
(1)
(2)
(3)
给下列有机物命名
A.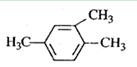 |
B.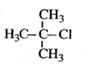 |
C.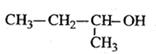 |
D.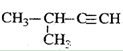 |