根据①碳原子的电子层结构和每两个原子之间方能形成共用电子对而成为共价键;②烃分子中,每减少两个氢原子会减少两根碳氢键而增加一根碳碳键;③把一对共用电子对作为一根键,碳碳双键则为两根键……,苯环用凯库勒式作讨论,碳原子数用n表示。
(1)已知碳的一种同素异形体富勒烯C60。有六十个碳原子构成,则该物质分子中共有共用电子对数为 。
(2)那么烷烃CnH2n+2中含碳碳键 根,含共价键总数为 。
(3)炔烃中有共价键数 ,其发生某一反应后产物中含有共价键3n根,则发生的反应是 ( )
A.与H2 1:1加成 B.与氯气发生1:2加成
C.与H2P 1:1加成 D.一定数目分子加聚成环状化合物
(4)某烃分子中含有碳碳键数为n+3,则该烃可能为 ( )
A.环烷烃 B.稠环芳香径 C.苯及其同系物 D.二炔烃
下列实验操作中不正确的是______________(填序号)。
| A.用托盘天平称取11.70g食盐 |
| B.利用任何强酸和强碱溶液相互反应均可测得中和热为57.3kJ/mol |
| C.用量筒量取12.36mL盐酸 |
| D.用酚酞作指示剂进行中和滴定时,当溶液由无色变为红色时立即停止滴定 |
E.用酸式滴定管盛装高锰酸钾溶液进行相关滴定。
下图的各方框表示有关的一种反应物或生成物(某些生成物已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。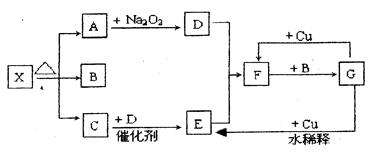
(1)写出下列各物质的化学式:
X:; F:;
(2)写出下列变化的反应方程式:
A→D:;
G→E:。
(3)实验室里,常用加热和的混合物的方法制取气体C,其反应方程式为:。(4)实验室收集C气体常作的方法是。
某钠盐溶液中可能含有阴离子:CO32-、SO32-、SO42-、Cl-、Br-、I-,为了鉴别这些离子,分别取少量溶液进行以下实验:
(1)加盐酸后,生成无色无味气体,该气体能使饱和石灰水变浑浊;
(2)加CCl4后,滴加少量氯水,震荡后CCl4层未变色;
(3)加BaCl2溶液后产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
(4)加稀HNO3酸化后,再加入过量AgNO3溶液,析出白色沉淀。
分析上述4个实验,写出每一步实验鉴定离子的结论与理由。
实验(1):;
实验(2):
;
实验(3):;
实验(4):。
按要求完成下列反应的化学方程式:
(1)碳和浓硫酸在加热条件下的反应:
;
(2)将氯气通入冷的消石灰中制取漂白粉:
;
(3)铝与NaOH溶液反应:
;
(4)在FeSO4溶液中加入NaOH溶液时,产生的白色絮状沉淀迅速变成灰绿色,最后变为红褐色。试写出上述变化的化学方程式:
。
请根据所学的电化学原理,解决以下问题。
(1)依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s) 设计的双液原电池,可以提供稳定的电流。装置如图所示,其中盐桥中装有琼脂—饱和KCl溶液。
回答下列问题:
①电极X的材料和电解质溶液Y分别为;
②盐桥中K+移向(填A或B);
③银电极发生的电极反应为。
(2)下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,(填X或Y)电极附近先变红色, X极上的电极反应式为。
②若要在铁制品上镀一定厚度的Cu层,Y电极反应式为
③若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g。该金属的相对原子质量是;