某钠盐溶液中可能含有阴离子:CO32-、SO32-、SO42-、Cl-、Br-、I-,为了鉴别这些离子,分别取少量溶液进行以下实验:
(1)加盐酸后,生成无色无味气体,该气体能使饱和石灰水变浑浊;
(2)加CCl4后,滴加少量氯水,震荡后CCl4层未变色;
(3)加BaCl2溶液后产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
(4)加稀HNO3酸化后,再加入过量AgNO3溶液,析出白色沉淀。
分析上述4个实验,写出每一步实验鉴定离子的结论与理由。
实验(1): ;
实验(2):
;
实验(3): ;
实验(4): 。
24.5gH2SO4的物质的量是,1.5molNa2CO3的质量是。
解释钠投入滴有酚酞试液的水中,产生下列现象的原因:
(1)钠浮在水面
(2)钠熔化成闪亮的小球
(3) 钠小球在水面四处游动,并发出“嘶嘶”声
钠小球在水面四处游动,并发出“嘶嘶”声
(4)滴有酚酞试液的水变红
在高温时,水蒸气与灼热的炭发生氧化还原反应的化学方程式是H2O+C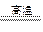 H2+CO,其中水是剂。硫在氧气中燃烧的化学方程式是,其中硫是剂。
H2+CO,其中水是剂。硫在氧气中燃烧的化学方程式是,其中硫是剂。
下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质,B是一种红棕色固体。(反应过程中 生成的水及其他产物已略去)
生成的水及其他产物已略去)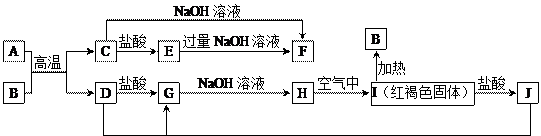
请回答以下问题:
(1)B是,H是,I是,F是。(填化学式)
(2)写出A和B的反应的化学方程式为。[来
(3)写出J与D反应转化为G的离子方程式。
气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋中的主要成分。A能发生以下转化: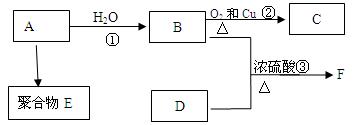
(1)A的结构简式为: 。
(2)E是(写结构简式);D中含官能团名称;
(3)写出相应转化过程的反应化学方程式
②: 反应类型: 反应
③:反应类型: 反应