下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质,B是一种红棕色固体。(反应过程中 生成的水及其他产物已略去)
生成的水及其他产物已略去)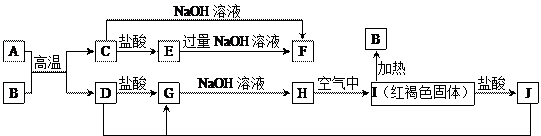
请回答以下问题:
(1)B是 ,H是 ,I是 ,F是 。(填化学式)
(2)写出A和B的反应的化学方程式为 。[来
(3)写出J与D反应转化为G的离子方程式 。
0.2 mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2 mol。试回答:
(1) 烃A的分子式为______________。
(2) 若取一定量的烃A完全燃烧后,生成B、C各3 mol,则有______g烃A参加了反应,燃烧时消耗标准状况下的氧气______L。
(3) 若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为______________________。
(4) 若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构
(5) 比烃A少2个碳原子的同系物有________种同分异构体,其中能和H2发生加成反应生
成2甲基丙烷的烯烃的名称是__________________。
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示: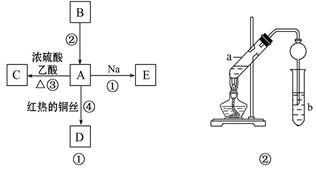
(1)写出B的结构简式______________;A中官能团的名称为______________。
(2) 写出下列反应的化学方程式
反应①________________________________________________________
反应④________________________________________________________
(3) 实验室利用反应③制取C,常用上图②装置:
①a试管中的主要化学反应的方程式为:____________________________
________________________________________________________________。
② 在实验中球形干燥管除起冷凝作用外,另一个重要作用是____________
________________________________________________________________。
③ 试管b中观察到的现象是________________________________________。
(1) 根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物属于芳香烃的是____________(填字母)。
预测该芳香烃____________ (填“能”或“不能”)在光照的条件下与氯气发生反应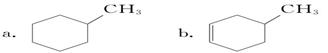
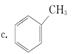
②下列有机物属于醛类的是___________(填字母)。
(2)化合物X的结构简式为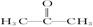
①X分子的核磁共振氢谱有___________个峰。
②X的一种同分异构体Z的结构简式为H2C=CH—CH2OH,请写出Z与H2在一定条件下反应的化学方程式________________________________________________。
根据下面的反应路线及所给信息填空 (6分)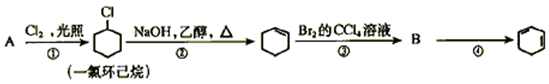
(1)①的反应类型是。③的反应类型是。
(2)反应④的化学方程式是 。
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):
已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是___________________________________;
(2)化合物甲的电子式是___________________________________;