(1)现有A、B、C三种化合物,各取40g相混合,完全反应后,得18g B和49g C ,还有D生成。已知D的式量为106,现将22g A和11g B混合反应,能生成D mol。
(2)200mL某溶液中含有的离子及其物质的量如下:
| 离子 |
H+ |
K+ |
NO3- |
SO42- |
| 物质的量(mol) |
0.5 |
0.1 |
0.6 |
0.15 |
该溶液中还含有的离子一定是下列中的 (填序号),该离子的浓度为
A.Al3+ B.Cl- C ClO- D.Fe2+
(3)某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水
发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。依据溶液颜色的变化,回答下列问题:
(ⅰ)加入以上药品的顺序是(写序号) ____________________________________________。
(ⅱ)①→②反应的化学方程式为_______________________________________________。
(ⅲ)溶液由棕黄色变为蓝色的原因是___________________________________________。
如图所示:丁可能是强酸也可能是强碱。
(1)若丙是潜艇的供氧剂,请写出甲与水反应的离子方程式;若等物质的量的甲,乙,丙,丁的固体投入到足量且等量的水中完全反应所得溶液的质量分数由大到小的顺序是(用化学式表示)。
(2)若乙是能使品红溶液褪色的气体,请写出乙→丙的化学反应方程式;请写出乙可使氯水褪色的离子方程式__________________________.
(3)若甲可作为制冷剂,请写出甲→乙的化学反应方程式;将等量的铜粉分别与过量浓的丁溶液、稀的丁溶液反应,消耗丁的物质的量:前者后者,反应中转移的电子总数:前者后者(填“>”、“=”或“<”)
某学生课外活动小组利用下图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是溶液;加热时溶液由红色逐渐变浅的原因是。(用化学反应方程式表示)
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是溶液;加热时溶液由无色变为红色的原因。
(本题共2小题,共10分)
(1)相同温度下等物质量浓度的下列溶液中,
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.(NH4)2SO4 |
①pH值由大到小的顺序是(用对应的字母填写)。
②NH4+离子浓度由大到小的顺序是(用对应的字母填写)。
③若上述溶液的pH值相同,则其物质的量浓度关系是(用对应的字母填写)。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=________。
②完全沉淀后,溶液的pH=________。
如图为相互串联的甲、乙两电解池。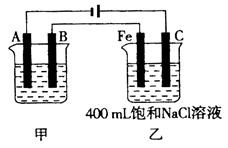
试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是(填电极材料),B是(填电极材料),应选用的电解质溶液是。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____色。乙电解池的电解方程式为。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是mL。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于。
有A、B、C、D、E、X、Y七种元素都是元素周期表中前36号元素。其相关信息如下:
| 相关信息 |
|
| ① |
A的基态原子2p轨道中有三个未成对电子 |
| ② |
A、B元素的常见单质是构成空气的主要成分 |
| ③ |
C 原子基态时最外层电子数是其内层电子总数的2倍 |
| ④ |
D 原子核外占有9个轨道,且只有1个未成对电子 |
| ⑤ |
E、X、Y三种元素处于第4周期;E元素的正三价离子的3d亚层为半充满,X元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;Y元素原子的4p轨道上有3个未成对电子 |
(1)B元素原子的价层电子的电子排布图为
(2)X的基态原子的电子排布式为。
(3)指出E元素在元素周期表中的位置____________________。
(4)D离子结构示意图是。
(5)比较A、B、C三种元素的第一电离能由大到小的顺序是_____________(用元素符号表示)。
(6)A元素最高价氧化物对应的水化物的稀溶液与X 反应的离子方程式为。
(7)已知化合物Y2B3在稀硫酸溶液中可被金属锌还原为YH3(Y的氢化物),产物还有ZnSO4和H2O,该反应的化学方程式是__________________________________________。