航天器的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化放热引发高氯酸铵反应,其反应式为:2NH4ClO4=N2↑+4H2O↑+Cl2↑+2O2↑。反应放出大量热,下列对该反应的叙述中,错误的是
| A.NH4ClO4既是氧化剂,又是还原剂 |
| B.反应中只有Cl元素被还原 |
| C.1mol NH4ClO4完全反应时,转移14 mol电子 |
| D.从能量角度看,化学能主要转变为热能和动能 |
下列实验操作与预期实验目的一致的是
| 选项 |
实验操作 |
实验目的 |
| A |
溴乙烷在氢氧化钠存在下加热水解后,加入硝酸银溶液 |
可检验溴元素的存在 |
| B |
苯中有少量苯酚,加入浓溴水后,过滤 |
可除去苯中的苯酚 |
| C |
乙烷中有少量乙烯,通入酸性KMnO4溶液中 |
可除去乙烷中的乙烯 |
| D |
测苯与液溴反应前后的pH |
验证发生的是加成反应还是取代反应 |
普罗加比对癫痫、痉挛和运动失调均有良好的治疗效果,其结构如图所示,有关普罗加比的说法正确的是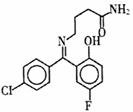
| A.该分子在1H核磁共振谱中有12个峰 |
| B.一定条件下,1 mol普罗加比最多能与2 mol H2发生加成反应 |
| C.久置在空气中的普罗加比会因氧化而变质 |
| D.普罗加比可以和NaOH溶液、Na2CO3溶液反应,也可以和盐酸反应 |
胡椒酚是植物挥发油的成分之一,它的结构简式为:HO- -CH2CH=CH2,下列叙述中正确的是
-CH2CH=CH2,下列叙述中正确的是
| A.1mol胡椒酚最多可与4molH2发生反应 |
| B.1mol胡椒酚最多可与4mol溴发生反应 |
| C.胡椒酚中所有原子可以共平面 |
| D.胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,也可以使用仪器鉴定法,下列鉴别方法,不能对二者进行区别的是
| A.加入金属钠 | B.利用质谱法 |
| C.燃烧法 | D.利用核磁共振氢谱仪 |
化学与生活密切相关,下列说法正确的是
| A.福尔马林可用于保存海鲜产品 |
| B.鸡蛋清中加入CuSO4溶液会发生变性 |
| C.合成橡胶与光导纤维都属于有机高分子材料 |
| D.丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 |