(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随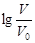 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是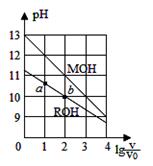
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当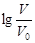 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则  增大 增大 |
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是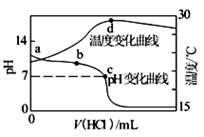
| A.氨水的电离程度a>b>c |
| B.a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
| C.c点时消耗盐酸体积V(HCl)<20.00ml |
| D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热 |
水的电离平衡为H2O H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.在稀硫酸中加入少量氢氧化钠固体,溶液导电性增强 |
| B.饱和碳酸钠溶液中:c(Na+)=2c(CO32-) |
| C.饱和食盐水中:c(Na+) + c(OH-)c(Cl-)+ c(H+) |
| D.pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol·L-1 |
25℃时,在10mL浓度均为0.1mol/L的NaOH和NH3•H2O混合溶液中滴加0.1mol•L﹣1盐酸,下列有关溶液中粒子浓度关系正确的是
| A.未加盐酸时:c(OH﹣)>c(Na+)=c(NH3•H2O) |
| B.加入10mL盐酸时:c(NH4+)+c(H+)=c(OH﹣) |
| C.加入盐酸至溶液pH=7时:c(Cl﹣)=c(Na+) |
| D.加入20mL盐酸时:c(Cl﹣)=c(NH4+)+c(Na+) |