有机物A的结构简式为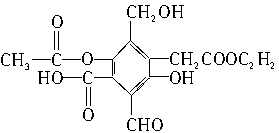
(1)A与过量NaOH完全反应时,A与参加反应的NaOH物质的量之比为____________。
(2)A与新制Cu(OH)2完全反应时,A与参加反应的Cu(OH)2物质的量之比为_________,其中A与被还原的Cu(OH)2的物质的量之比为__________。
(3)A与过量NaHCO3完全反应时,A与参加反应的NaHCO3物质的量之比为___________。
试用化学方法除去下列物质中混有的少量杂质,要求除杂试剂均过量,若为溶液中的离子反应请写出其离子方程式,否则写化学方程式。并写出相应的分离方法。
(1)除去FeCl2溶液中混有的少量FeCl3;方程式: ______________。分离方法:______
(2)除去CO2气体中混有的少量HCl;方程式:_______________。分离方法:______
(3)除去NaCl溶液中混有的少量NaBr;方程式:__________________。分离方法:______
用化学式简要表示下面的反应,并在括号里指出基本反应类型(化合反应或分解反应):
(1)磷在空气中燃烧:
(2)铁丝在氧气中燃烧:
(3)电解水:.
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Ba2+、NO3-、SO42-、Cl-、CO32-,实验如下:
| 实验步骤 |
实验现象 |
| ①取少量原溶液,加入几滴酚酞试液 |
溶液变成红色 |
| ②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4 |
有无色气体产生,该气体遇空气变成红棕色 |
| ③取少量原溶液,加入BaCl2溶液 |
有白色沉淀生成 |
| ④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液 |
有白色沉淀生成 |
由此判断:
(1)溶液中肯定存在的离子是_____________,肯定不存在的离子是________________,可能存在的离子是________________。
(2)实验②中生成无色气体的离子方程式是________________________________。
(3)为进一步确定可能存在的阴离子,应该补充的实验设计是__________________。
(10分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成。(提示:铝与氧化铁发生的反应称为铝热反应)
②另取20g A全部溶于0.15L 6.0mol·L-1盐酸中,得溶液C。
③将①中得到的单质B和溶液C反应,放出气体1.12L(标准状况下),同时生成溶液D,还残留固体B。
④用KSCN溶液检验时,溶液D不变色。
(1)反应①的产物中的单质B是________。
(2)②所发生各反应的化学方程式是:___________________________________。
(3)若溶液D的体积仍为0.15L,则该溶液中c(Mg2+)为________,c(Fe2+)为________(保留小数点后两位)
(1)白色的Fe(OH)2在空气中发生的颜色变化为________________________;
(2)写出硅酸钠溶液在空气中变质的化学方程式:____________________________;
(3)写出用熟石灰吸收氯气制漂白粉的化学方程式:;
(4)将CaMg3Si4O12改写为氧化物的形式:__________________________________。