①纤维素 ②甲酸甲酯 ③淀粉 ④甲醛 ⑤丙酸 ⑥乳酸(α羟基丙酸) ⑦乙二醇 ⑧乙酸
| A.②③④⑥ | B.②④⑥⑧ | C.①③④⑦ | D.②④⑤⑧ |
可逆反应mA(s)+nB(g) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
| A.达平衡后,加入催化剂则C%增大 |
| B.化学方程式中n>e+f |
| C.达平衡后,若升温,平衡右移 |
| D.达平衡后,增加A的量有利于平衡向右移动 |
在恒温、恒容的密闭容器中进行反应A(g) B(g)+C(g)。若反应物的浓度由3 mol·L-1降到1.8 mol·L-1需30 s,那么反应物浓度由0.8 mol·L-1降至0.2 mol·L-1所需反应时间为()
B(g)+C(g)。若反应物的浓度由3 mol·L-1降到1.8 mol·L-1需30 s,那么反应物浓度由0.8 mol·L-1降至0.2 mol·L-1所需反应时间为()
| A.15 s | B.大于15 s | C.小于15 s | D.无法判断 |
下列叙述不正确的是()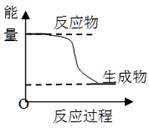
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,原因是增加了活化分子的百分数 |
| C.某化学反应的能量变化如上图所示,则该反应的△H>0,△S>0 |
| D.H3PO4的电离常数:K1>>K2>>K3 |
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该盐是()
| A.Fe2(SO4)3 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
在下列所示的转化关系中,x不可能是()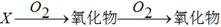
| A.N2 | B.Si | C.Na | D.C |