
已知F、H均是具有香味的液体,F为E的三聚物,并且有特殊的六元环状对称结构。
(1)A的名称是________________________________________;
F的结构式为________________________________________;
H的同类物的异构体还有(写结构简式) ____________________________________________。
(2)写出D E的化学方程式:__________________________________________________。
E的化学方程式:__________________________________________________。
写出B C的离子方程式:____________________________________________________。
C的离子方程式:____________________________________________________。
随着人类社会活动的加剧,我们地球人已面临能源危机,能高效地利用现有能源和开发新能源已受到各国的高度重视。试回答下列问题:
(1)为提高燃料利用率,可通过改进汽油组成的办法来改善汽油的燃烧性能。例如,“无铅汽油”是在汽油中加入CH3OC(CH3)3得到的,在CH3OC(CH3)3分子中必然存在的原子间连接形式有(填写编号)。①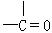 ,②
,②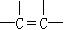 ,③
,③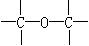 ,④
,④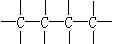 。
。
(2)天然气燃烧的产物无毒、热值高,而且管道输送方便,是值得推广的一种清洁能源,已成为我国西部开发的重点项目之一。天然气的主要成分是,它的空间结构是,下列说法中能证明它是该结构的理由是(填写编号)。
①其一氯取代物不存在同分异构体,②其二氯取代物不存在同分异构体,③它是非极性分子。
(3)为解决能源危机,有效开发民用氢能源是一条卓有实效的途径,为制得廉价的氢气,下列制氢方法中可行的途径是(填写编号)。①电解水②锌和稀硫酸反应③光解海水
根据所学知识回答下列问题,在如图所示装置中 ,
,
(1)若烧杯中溶液为稀硫酸,则观察到的现象为,正极反应式为,负极反应式为,
该装置中的能量变化形式为。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为,装置中总反应方程式为。
X、Y、Z为三种短周期元素,他们在周期表中的位置关系如图所示 。据此回答下列问题:
。据此回答下列问题:
(1)X元素的名称为,它形成的单质为(用分子式表示); He。若该元素的某种原子内核内中子数与质子数相等,则该原子的摩尔质量是;结合最近卫星发回的图片预测,月球的土壤中吸附着数百万吨的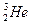 ,上述原子与
,上述原子与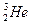 的关系是。
的关系是。
(2)Y元素形成单质的电子式是,Y单质的氧化性(填“强于”或者“弱于”)O2的氧化性,并用相应的化学方程式说明。
(3)元素Z在自然界中的存在形态为(填序号)①只有化合态,②只有游离态,③既有游离态,又有化合态;含Z元素的某些化合物燃烧后会造成严重的大气污染,其主要原因是。
(4)Y元素、Z元素与H2化合时的能量变化是,(填“都放热”、“都吸热”、“前者放热,后者吸热”或者“前者吸热,后者放热”),能量变化的大小关系为前者(填“>”、“=”或者“<”)。
麻醉剂是手术台上不可缺少的药品,它可使患者在接受治疗中免受疼痛的折磨。氯仿、氙气、乙醚等是临床上常见的麻醉剂,请回答下列问题:
(1)麻醉剂氯仿(CHCl3)属于下列哪类物质(填序号);氯仿常因保存不善而被氧化,产生剧毒物光气(COCl2),其反应方程式为:2CHCl3+O2 2HCl+2COCl2。为防止发生医疗事故,使用前可用于检验氯仿是否变质的试剂是(填序号)。
2HCl+2COCl2。为防止发生医疗事故,使用前可用于检验氯仿是否变质的试剂是(填序号)。
①烃②无机物③氯代烃④淀粉碘化钾溶液⑤NaOH溶液⑥酚酞溶液⑦硝酸酸化的硝酸银溶液
(2)人们曾用体积分数为80%的氙气和20%的氧气组成的混合气体,作为无副作用的麻醉剂。疝、氧在元素周期表中的位置分别为、,其中疝的原子序数是。已知氙在一定条件下可与氟气生成氟化物:若取1mol氙气和3.5mol氟气于一密闭容器内充分反应后,余下了1.5mol氟气,同时有白色固体生成,则白色固体的化学式为。
V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图: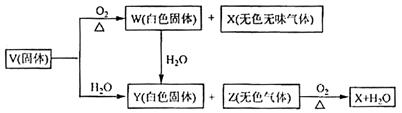
(1)5种化合物分别是V 、W 、X 、Y 、Z 。(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 。
(3)V的电子式是 。