麻醉剂是手术台上不可缺少的药品,它可使患者在接受治疗中免受疼痛的折磨。氯仿、氙气、乙醚等是临床上常见的麻醉剂,请回答下列问题:
(1)麻醉剂氯仿(CHCl3)属于下列哪类物质(填序号) ;氯仿常因保存不善而被氧化,产生剧毒物光气(COCl2),其反应方程式为:2CHCl3+O2 2HCl+2COCl2。为防止发生医疗事故,使用前可用于检验氯仿是否变质的试剂是(填序号) 。
2HCl+2COCl2。为防止发生医疗事故,使用前可用于检验氯仿是否变质的试剂是(填序号) 。
①烃②无机物③氯代烃④淀粉碘化钾溶液⑤NaOH溶液⑥酚酞溶液⑦硝酸酸化的硝酸银溶液
(2)人们曾用体积分数为80%的氙气和20%的氧气组成的混合气体,作为无副作用的麻醉剂。疝、氧在元素周期表中的位置分别为 、 ,其中疝的原子序数是 。已知氙在一定条件下可与氟气生成氟化物:若取1mol氙气和3.5mol氟气于一密闭容器内充分反应后,余下了1.5mol氟气,同时有白色固体生成,则白色固体的化学式为 。
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将SO2转化为重要化工原料C
若A为SO2,B为O2,则负极的电极反应式为:________________________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
① 0~6 min内,反应的平均速率v(Cl2)= ;
② 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③ 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④ 随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)______________T(15)(填“<”、“>”或“=”)。
发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g)△H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g)△H=-242kJ/mol
(1)气态肼和二氧化氮反应的热化学方程式为:_________________。
(2)有人认为若用氟气代替作氧化剂,则反应释放的能量更大,气态肼和氟气反应的热化学方程式为:__________________。
在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)△H<0。
(1)保持容器容积不变,向其中加入1molH2,反应速率 理由是 。
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率 理由是 。
(3)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率________________,理由是________________。
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率________________,理由是______________。
(5)提高反应的起始温度,反应速率______________,理由是______________。
某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析: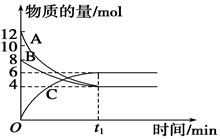
(1)反应的化学方程式为__________________。
(2)从开始到t1 min末时,用物质C表示的反应速率为____________________。
反应3Fe(s)+4H2O====Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率 (填变快、不变、变慢,以下相同)。
(2)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。