医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙为原料(含量为97.5%A,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下:
(1)除杂操作时加入试剂A,调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+。试剂A可以选择 ________________________________。
a.Ca(OH)2 b.NaOH c.NH3 d.Na2CO3
(2)检验溶液1中是否含Fe3+的方法是____________________________
(3)请指出下列操作的名称:操作1_______;操作2___________;请指出操作1中所用的玻璃仪器的名称_____________________。
(4)写出加入碳酸铵所发生的反应的离子方程式_____________;写出溶液2的一种用途_________。
(5)准确称取100 g工业碳酸钙粉末,通过上述方法理论上可以制得质量分数为99%的医药级二水合氯化钙的质量为____________。
(6分)根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物属于芳香烃的是 (填字母),
a.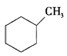 b.
b.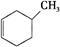 c.
c.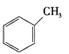
②下列有机物属于羧酸类的是 (填字母)。
a.CH3CHOb. c.
c.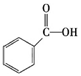
③下列有机物属于糖类的是 (填字母)。
a.油脂b.纤维素c.蛋白质
“西气东输”中的“气”指天然气,其主要成分的化学式是 ,结构式是__________。一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1 E2(填“>”或“<”),该反应_______ (填“放出”或“吸收”)能量。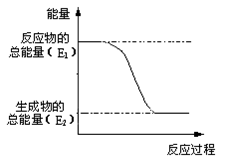
[化学—选修5:有机化学基础](15分)某有机化合物A的结构简式如图所示: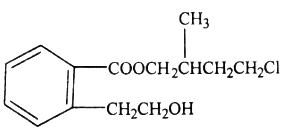
回答下列问题:
(1)A的分子式为__________________。
(2)A在NaOH水溶液中加热得到B和C,C是芳香族化合物,C则的结构简式是_____________。
(3)C酸化后可得F,F不能发生的反应类型是(填写字母代号)__________________。
a.取代反应
b.加成反应
c.消去反应
d.加聚反应
e.氧化反应
f.还原反应
(4)B与足量的某饱和一元羧酸D充分反应后生成E,E和B的相对分子质量之差为84,则D的摩尔质量为__________________。
(5)F可以发生如下转化,且G与H互为同分异构体。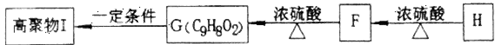
请写出:①H的结构简式__________________。 ②由F生成的G化学方程式________________。
(6)符合下列三个条件的F的同分异构体的数目有多种,任写出其中1种的结构简式____________。
①含有邻二取代苯环结构;
②F具有相同的官能团;
③不与FeCl3溶液发生显色反应。
[化学一选修3:物质结构与性质](15分)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图: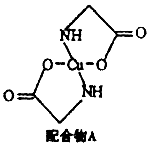
(1)Cu元素基态原子的电子排布式为 ________________。
(2)配合物A中碳原子的轨道杂化类型为________________, 配合物A中不存在( )
A.极性键
B.非极性键
C.氢键
D.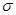 键
键
E.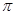 键
键
F.离子键
(3)lmol氨基乙酸钠(H2N-CH2-COONa)含有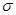 键的数目为_________。
键的数目为_________。
(4)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体且为负一价阴离子:________(写化学式)。
(5)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是________,铜离子的配位数是________。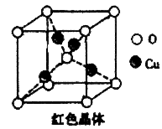
(6)配合物A中元素C、H、N、O组成的化合物CH4和NO,在400~500°C和Pt做催化剂下,能转化成无毒无害的物质,利用该反应可以控制机动车尾气排放。该反应方程式为:________________。
[化学选修——2.化学与技术](15分)碳酸钠是一种重要的化学基本工业产品。比利时人索尔维发明了氨碱法生产碳酸钠,氨碱法生产原理示意图如下:
我国化工专家设计了联合制碱法,联合制碱法生产原理示意图如下: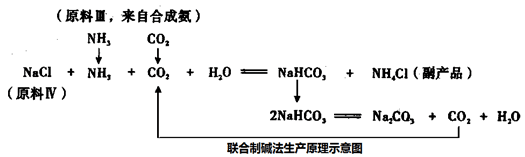
请回答下列问题:
(1)从索尔维制碱法生产原理示意图可知,氨碱法的总反应方程式为 ______________。按照绿色化学原则,理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,实现废弃物的零排放。计算索尔维制碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)______________。
(2)试列举出索尔维制碱法的两大缺点。
①______________;②_____________。
(3)设计联合制碱法的我国化工专家是______________;
(4)从联合制碱法生产原理示意图可知,原料III 中的CO2来自合成氨,指出步骤名称,并写产生CO2化学方程式。
步骤I:__________,化学方程式_________________,
步骤II:__________,化学方程式__________。