有一新型抗癌药,其分子式为C47H51NO14,它是由如下的酸A和醇反应而生成的一种酯。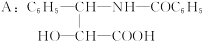
B.R—OH(R是一个含C、H、O的基团)
(1)A在无机酸催化下可水解,其反应方程式为______________________________。
(2)A水解所得到的产物是否是天然蛋白质水解产物?__________,原因是______________。
(3)写出ROH的分子式__________。
在灾难性事故中,骨折时有发生,通常用石膏来固定骨折部位。石膏可分为熟石膏(CaSO4·1/2H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是(填化学式或名称)。石膏定型时发生的化学反应方程式:。
1986年,在瑞士苏黎世工作的两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得1987年的诺贝尔物理学奖。这种超导材料的晶体结构如右图所示,其化学式为YBa2Cu3O7。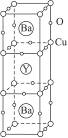
(1)已知该化合物中各元素的化合价为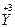 、
、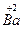 、
、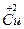 和
和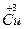 。试计算Cu在化合物中的平均化合价为______________,两种价态Cu的原子个数之比为____________。
。试计算Cu在化合物中的平均化合价为______________,两种价态Cu的原子个数之比为____________。
(2)用氧化物的形式表示该化合物的组成:____________________________________。
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。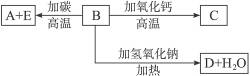
请填空:
(1)形成单质A的原子的结构示意图为__________,它的最高化合价为__________。
(2)B的化学式(分子式)为__________,B的晶体类型为__________,B和碳反应生成A和E的化学方程式是______________________________。
(3)C的化学式(分子式)为__________,D的化学式(分子式)为__________。
钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强碱反应。红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一称金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石、炭粉混合在高温条件下通入氯气制TiCl4和一种可燃性气体。该反应的化学方程式为:___________________________,该反应的还原剂是________________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式:
____________________________________________________;
(2)如何由上述所得产物中获取金属钛?简述步骤并写出有关反应的化学方程式
_______________________________________________________________________________
钇(Y)是激光材料、超导材料和磁性材料中的重要元素,在激光诊断、激光治疗领域、超导发电机、超导磁悬浮列车、微波领域中有着重要作用。
(1)有一种铁、氧、钇三种元素组成的磁性材料,经测定该材料中钇、铁的原子个数之比为3∶5,氧的质量分数约为26.0%,则该材料的化学式为___________,钇、铁的化合价分别为___________。
(2)某钇矿石的主要成分是Be2YxFeSi2O10,该矿石与过量氢氧化钠共熔后,加水溶解,所得沉淀物中有Y(OH)3和Fe2O3(反应时Y的化合价不变,Fe由+2价转变为+3价)。试推算:此钇矿石的化学式中x=___________。若改用氧化物的形式表示其组成,则化学式为___________。