A、B、C三种一元弱酸的浓度均为0.1 mol·L-1,在室温下,A溶液中C(OH-)=7.6×10-12 mol·L-1,B溶液中水电离产生的H+浓度为10-10 mol·L-1,C溶液的pH=3,则三种溶液的酸性由强到弱的顺序是______________________________。
化合物
和单质
在一定条件下反应可生成化合物
。回答下列问题:
(1)已知
的熔点和沸点分别为-93.6 ℃和76 ℃,
的熔点为167 ℃。室温时
与气体
反应生成lmol
,放出热量123.8 kJ。该反应的热化学方程式为。
(2)反应
 在容积为10 L的密闭容器中进行。起始时
和
均为0.2
。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
在容积为10 L的密闭容器中进行。起始时
和
均为0.2
。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a从反应开始至达到平衡时的反应速率
=。
②图中3组实验从反应开始至达到平衡时的反应速率
由大到小的次序为(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b、c。
③用
表示开始时总压强,
表示平衡时总压强,
表示
的平衡转化率,则
的表达式为;实验
和
的平衡转化率:
为、
为。
、
、
、
、
为短周期元素,非金属元素
最外层电子数与其周期数相同,
的最外层电子数是其所在周期数的2倍。
在
中充分燃烧能生成其最高价化合物
。
与
具有相同的电子数。
在
中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)
在周期表中的位置是,写出一种工业制备单质F的离子方程式。
(2)
、
、
组成的一种盐中,
的质量分数为43%,其俗名为,其水溶液与
单质反应的化学方程式为;在产物中加入少量
,反应后加人
并振荡,有 机层显色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 |
组成和结构信息 |
| 含有
的二元离子化合物 |
|
| 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
|
| 化学组成为 | |
| 只存在一种类型作用力且可导电的单质晶体 |
的化学式为;
的化学式为;
的电子式为;
的晶体类型是。
(4)由
和
、
元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为。
[物质结构与性质]
含有
的
悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
。
(1)
+基态核外电子排布式为
(2)与
-互为等电子体的一种分子为(填化学式)。
(3)醛基中碳原子的轨道杂化类型是;
乙醛分子中含有
的键的数目为。
(4)含有
的
悬浊液与乙醛反应的化学方程式为。
(5)
在稀硫酸中生成
和
。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为。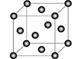
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收
后的溶液加入到如题20图-1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
①写出电解时阴极的电极反应式:。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成。
(2)将
和空气的混合气体通入
、
、
的混合溶液中反应回收
,其物质转化如题20图-2所示。
①在图示的转化中,化合价不变的元素是。
②反应中当有1
转化为硫单质时,保持溶液中
的物质的量不变,需要消耗
的物质的量为。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含
,可采取的措施有。
(3)
在高温下分解生成硫蒸气和
。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图-3所示,
在高温下分解反应的化学方程式为。


非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
请回答下列问题:
(1)非诺洛芬中的含氧官能团为和(填名称)。
(2)反应①中加入的试剂
的分子式为
,
的结构简式为(3)在上述五步反应中,属于取代反应的是(填序号)。
(4)
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与
溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:
(5)根据已有知识并结合相关信息,写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: