(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g) pC(g)+qD(s)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(s)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。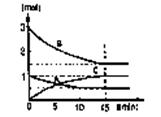
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示): 。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g) 2C(g)△H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g)△H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空: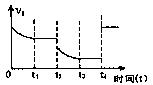
①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
)写出下列物质在水溶液里的电离方程式:
(1)硫酸铁;
(2)氢氧化铝;
(3)硫酸氢钾。
已知卤代烃在氢氧化钠溶液中可以发生如下反应: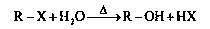
某芳香烃A有如下七步转化,按要求填空: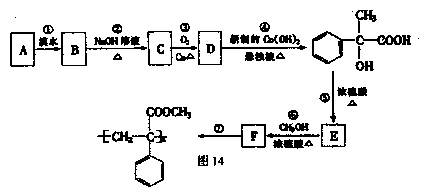
(1)写出反应类型:反应①;反应⑦
(2)写出结构简式:A;F
(3)写出化学方程式:
反应③
反应⑤
常见的短周期元素A、B、C、D、E的原字序数穰沃增夫。常温下,A、C可形成A2C2和A2C两种液态化合物,B原子最外层电子数是次外层电子数的2倍,D原子电子层数与最外层电予数相等,E与C同主族。
(1)上述五种元素中,非金属性最强的是(填写元素名称)。
(2)元素D形成的简单离子的原子结构示意图为。
(3)A的单质与C的单质在强酸性条件下构成燃料电池,其正极反应式为。
(4)上述五种元素,由其中三种元素组成的易溶于水的物质中,能促进水电离的物质是:
(写出一种物质的化学式,下同),能抑制水电离的物质是:。
(5)常温常压时,2.8gBC气体在3.2gC2气体中完全燃烧,生成BC2气体时放出28.3kJ的热量,则表示BC燃烧的热化学方程式为。
已知卤代烃在氢氧化钠溶液中可以发生如下反应: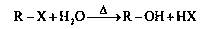
某芳香烃A有如下七步转化,按要求填空: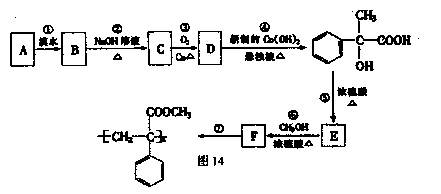
(1)写出反应类型:反应①;反应⑦
(2)写出结构简式:A;F
(3)写出化学方程式:
反应③
反应⑤
常见的短周期元素A、B、C、D、E的原字序数穰沃增夫。常温下,A、C可形成A2C2和A2C两种液态化合物,B原子最外层电子数是次外层电子数的2倍,D原子电子层数与最外层电予数相等,E与C同主族。
(1)上述五种元素中,非金属性最强的是(填写元素名称)。
(2)元素D形成的简单离子的原子结构示意图为。
(3)A的单质与C的单质在强酸性条件下构成燃料电池,其正极反应式为。
(4)上述五种元素,由其中三种元素组成的易溶于水的物质中,能促进水电离的物质是:
(写出一种物质的化学式,下同),能抑制水电离的物质是:。
(5)常温常压时,2.8gBC气体在3.2gC2气体中完全燃烧,生成BC2气体时放出28.3kJ的热量,则表示BC燃烧的热化学方程式为。