研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。
若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
| A.该反应使用催化剂意义不大; |
| B.该反应发生将在很短时间内完成; |
| C.该反应达到平衡时至少有一种反应物百分含量很小; |
| D.该反应一定是放热反应; |
(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时CO转化率________(填“增大”,“不变”或“减小”,下同)平衡常数:________。
(iv)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强__________倍。
(2)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
H2(g)+1/2O2(g)= H2O(l) △H=-285.8KJ/mol
则CO2(g)和H2(g)反应生成液态水的热化学方程式为:_________________________。
W、X、Y、Z为短周期内(除稀有气体元素外)的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,X与Z属于同一主族的元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素的质子数之和的3倍。
(1)由此可知元素W为_______; Y 为_______;(都填元素名称)
(2)Z位于元素周期表中第______周期,第____族
(3)W分别与X、Z能形成相应的氢化物,这两种化合物的沸点由高到低的顺序为______________(用分子式表示)
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________。
(5)由上述四种元素组成盐反应的离子方程式____________________________
(6) Z的低价氧化物通入Cl2单质的水溶液中,发生反应的化学方程式为____________。
(10分)现有A、B、C三种物质,均含同一种元素,一定条件下其转化关系如下(部分产物已略去):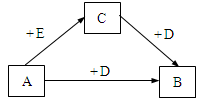
请回答:
(1)若A是短周期元素组成的金属单质,D是短周期中原子半径最大的主族元素形成的氢氧化物。
① 组成A的元素在周期表中的位置是。
② 当A与D的溶液反应转移1.5 mol电子时,产生气体的体积(标准状况)为,
A与D反应的离子方程式为。
(2)若A是常见金属单质,B的溶液为黄色,D的组成元素的原子M层电子数比L层少1。
① 下列关于C的说法正确的是(填字母)。
A.其溶液为无色 B.遇KSCN溶液变红色
C.既有氧化性也有还原性 D.其溶液可用于吸收氯气
② B与HI溶液反应可生成C、E和一种单质,该反应的化学方程式是。
14分)现有 A、B、C、D 四种短周期元素 ,其原子序数依次增大 。已知 A、C 位于同一主 族 、A 在周期表中原子半径最小 、B、D 的最外层电子数相等 、且 B、D 能形成 DB 2和 DB3两种化合物 。请回答下列问题 :
(1)写出由 A、B、C、D 四种元素中的两种元素组成 、且具有漂白作用的三种物质的化学式 、 、 。
(2)C 与 D 能形成化合物甲,写出化合物甲与稀盐酸的反应方程式 。
(3)仅由 B、C形成的一种化合物乙常做供氧剂,写出乙的电子式,又知乙与DB2可进行反应,写出相应的化学方程式。
(4)已知元素E比B元素的原子序数小1,则E元素的最高价含氧酸的稀溶液与铜反应的离子方程式为
已知:
①25℃时弱电解质电离平衡数;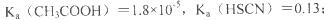
难溶电解质的溶度积常数: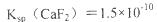
②25口C时,2×l0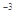 mol
mol 氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、c(F-)与溶液pH的变化关系,如下图所示:
氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、c(F-)与溶液pH的变化关系,如下图所示: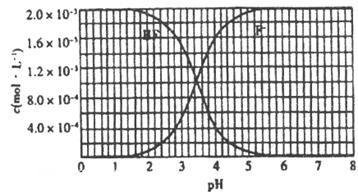
请根据以下信息回答下列问题:
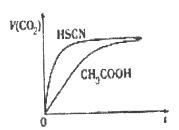
(1) 25℃时,将20mL 0.10 mol  CH3COOH溶液和20mL O.l mol
CH3COOH溶液和20mL O.l mol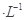 HSCN溶液分别与20mL 0.10 mol
HSCN溶液分别与20mL 0.10 mol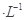 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为上图所示:
NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为上图所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因
是_____________________________________________________________,
反应结束后所得两溶液中,C(CH3COO-)_______c(SCN-)(填“>”、“<”或“=”)
(2) 25℃时,HF电离平衡常数的数值Ka≈_________。
(3)4×10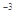 mol
mol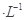 HF溶液与4×10
HF溶液与4×10 mol·
mol·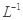 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
(1)电源B极是________极(填“正”或“负”)
(2)(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为
(3)欲用(丙)装置给钢镀银,G应该是_______(填电极材料),电镀液选_______溶液
(4)电解一段时间后,加入何种物质能使溶液恢复到原来浓度,甲应加入_________乙应加入__________。
(5)室温下,若从电解开始到时间为t时,若(甲)中某一电极增重0.64g,(乙)溶液的体积为200mL,则(乙)溶液的pH为_________。