据报道,苏州一女士骑自行车随助力车行走,因大雾堵车在许多助力车排放的尾气中呆久后突然晕倒,路人急将其送往医院抢救。化学兴趣小组同学看报后组织讨论以下两个问题,请你参考:
(1)该女士昏倒的原因: 。
(2)讨论中某同学为解决助力车污染空气的问题,提出以下几点建议:①用浓氢氧化钠溶液吸收尾气中有毒成分;②用灼热的氧化铜把尾气中有毒成分反应出去;③控制行驶的助力车的数量;④改进助力车发动机的结构,提高汽油燃烧效率。你认为切实可行的是 ,试分析不行的原因 。
27.冶炼金属常用以下几种方法:①以C、CO或H2做还原剂②以活泼金属Na、Mg等还原③利用铝热反应原理还原④电解法⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)
(1)Fe、Zn、Cu等中等活泼金属 。
(2)Na、Mg、Al等活泼或较活泼金属。
(3)Hg、Ag等不活泼金属。
(4)V、Cr、Mn、W等高熔点金属。
(5)K、Rb、Cs、Ti等金属通常还原方法是。
21.(8分)下图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量且少量的NO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L。已知:2NO2(g)  N2O4(g)
N2O4(g)


19.( 12分) 将物质的量均为3.00mol物质A、B混合于5L溶 器中,发生如下反应 3A+B 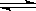 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示: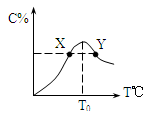
(1) T0对应的反应速率V正和V逆的关系是_____(用含“>”“<”“=”表示,下同);
(2) 此反应的正反应为______热反应;
(3) X、Y两点A物质正反应速率的大小关系是______________;
(4) 温度T<T0时,C%逐渐增大的原因是________________________;
(5) 若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为_______;若Y点时所耗时间为2 min,则B物质的反应速率为__________。
18.(9分) 按要求写热化学方程式:
(1) 已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
___________________________________________________________________。
(2) 25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________________________________________________________。
(3) 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g)ΔH2=-393.5 kJ/mol
③H2(g)+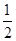 O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式______________________________________.
17.(10分) 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l )的燃烧热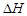 分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1) 用太阳能分解10 mol水消耗的能量是kJ;
(2) 甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃):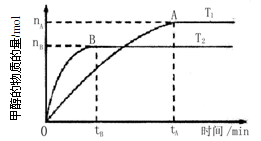
下列说法正确的是(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=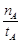 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4) 在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为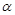 ,则容器内的压强与起始压强之比为.
,则容器内的压强与起始压强之比为.