有关化学用语正确的是 ( )
| A.乙烯的实验式: C2H4 |
| B.乙醇的结构简式: C2H6O |
C.四氯化碳的电子式:  |
| D.臭氧的分子式: O3 |
在373K时,N2O4  2NO2 △H>0把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
2NO2 △H>0把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
| A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1 |
| B.平衡时,N2O4的转化率为50% |
| C.平衡时,体系内NO2为0.04mol·L-1 |
| D.在2s时,体系内压强为反应前的1.1倍 |
在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,表明反应A(g)+2B(g) C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
| A.混合气体的密度 | B.混合气体的总物质的量 |
| C.混合气体的压强 | D.混合气体的总体积 |
右图是关于反应A2(g)+3B2(g) 2C(g) ⊿H<的平衡移动图象,影响平衡移动的原因可能是
2C(g) ⊿H<的平衡移动图象,影响平衡移动的原因可能是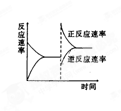
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
通常人们把拆开1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
A—A |
B—B |
A—B |
| 生成1 mol化学键时放出的能量 |
436 kJ·mol-1 |
243 kJ·mol-1 |
431 kJ·mol-1 |
则下列热化学方程式不正确的是()
A.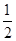 A2(g)+
A2(g)+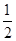 B2(g)=AB(g)ΔH=-91.5 kJ·mol -1
B2(g)=AB(g)ΔH=-91.5 kJ·mol -1
B.A2(g)+B2(g)=2AB(g)ΔH=-183 kJ·mol -1
C.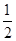 A2(g)+
A2(g)+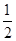 B2=AB(g)ΔH=+91.5 kJ·mol-1
B2=AB(g)ΔH=+91.5 kJ·mol-1
D.2AB(g)=A2(g)+B2(g)ΔH=+183 kJ·mol-1
钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:
TiO2→TiCl4 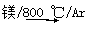 Ti
Ti
已知:①C(s)+O2(g)=CO2(g) ,ΔH1
②2CO(g)+O2(g)=2CO2(g) ,ΔH2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ,ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH为
| A.ΔH3+2ΔH1+2ΔH2 | B.ΔH3+2ΔH1+ΔH2 |
| C.ΔH3+2ΔH1-ΔH2 | D.ΔH3+2ΔH1-2ΔH2 |