下列各组中的离子能在溶液中大量共存的是( )
A.Fe3+、Na+、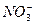 、OH- 、OH- |
B.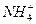 、Fe3+、 、Fe3+、 、 、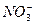 |
C. 、Cl-、Ca2+、Mg2+ 、Cl-、Ca2+、Mg2+ |
D.Ba2+、K+、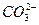 、Cl- 、Cl- |
下列离子方程式书写正确的是( )
A.少量SO2通入Ca(ClO)2溶液中:
B Fe(NO3)3溶液中加人过量的HI溶液-
CNaNO2溶液中加入酸性KMnO4溶液:
D NaHCO3溶液中加入过量的Ba(OH)2溶液:
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是( )
A.①②③④ B ①②⑤⑥
C.③⑤⑥⑦ D.①③④⑦
化学中常用图象直观地描述化学反应的进程或结果(图④纵坐标表示难溶物达到饱和时的浓度)。下列对图象描述正确的是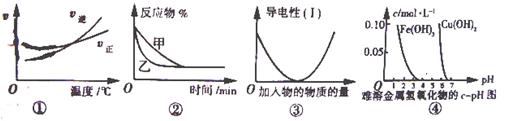
A.根据图①可判断可逆反应A2(g) +3B2(g) 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②可表示压强对可逆反应2A(g) +2B(g) 3C (g) + D(s)的影响,乙的压强大 3C (g) + D(s)的影响,乙的压强大 |
| C.图③可表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
D.根据图④,若除去CuSO4溶液中的 Fe3+可采用向溶液中加入适量CuO,至pH在4左右 Fe3+可采用向溶液中加入适量CuO,至pH在4左右 |
用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如下图,则下列说法不正确的是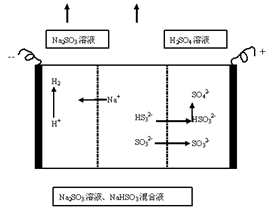
| A.阴极区电极反应式为:2H++2e-=H2↑ |
| B.该过程中的副产品主要为H2SO4溶液 |
| C.阳极室内HSO3-.SO32-被氧化为SO42- |
| D.10L 2mol/L NaOH溶液最多吸收标准状况下224L SO2 |
下列有关结论正确的是
| A.T℃时,Ba(OH)2溶液中c(H+)·c(OH-)=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,则混合溶液的pH=7 |
| B.pH相等的硫酸.盐酸.醋酸,都稀释1000倍,稀释后,pH最大的是醋酸 |
| C.0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液在常温时pH一定小于7 |
| D.在0.1mol/L的硫酸氢铵溶液中各离子浓度关系是:c(H+)>c(SO42-)> c(NH4+)> c(OH-) |