在Cu(NO3)2和AgNO3的混合溶液中加入一定量的锌粉,使之充分反应后,有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质是 。
(2)若反应后过滤,向所得固体物质加盐酸没有气体产生。则溶液中一定有 ,可能有 。
(3)若反应后过滤,向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,则此时溶液中含有的溶质为 。
已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为,E的基态电子排布式为,E3+与E2+的稳定性大小为。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为,电负性由小到大的顺序为。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的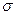 键和
键和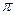 键的数目之比为;F、G对应的氢化物中键能大小为F—H键G—H键。
键的数目之比为;F、G对应的氢化物中键能大小为F—H键G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为。
[化学——有机化学基础]
肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。现测出A的核磁共振氢谱谱
图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:
试回答下列问题。
(1)肉桂酸甲酯的结构简式为。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。
用芳香烃A为原料合成G的路线如下:
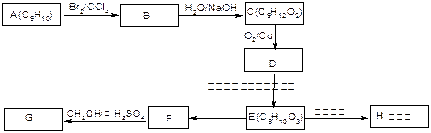
①化合物E中的含氧官能团有(填名称)。
②A→B的反应类型是,E→F的反应类型是,
③书写化学方程式
C→D
E→H
④中E的同分异构体甚多,其中有一类可用通式 表示(其中X、Y均不为H)
表示(其中X、Y均不为H)
符合上述通式且能发生银镜反应的同分异构体有四种,其中两种的结构简式如下,请写出其它两种的结构简式。 、
、 、、
、、
[化学——选修化学与生活]麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,此反应的化学方程式为______________________________,N2O也可以通过强还原性金属(如Mg)与稀HNO3反应制得,写出该反应的离子方程式________________________________。有关理论认为N2O与CO2分具有相似的结构(包括电子式),已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为_____________。
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气(COCl2): ,为了防止事故,使用前可用于检验氯仿是否变质
,为了防止事故,使用前可用于检验氯仿是否变质
的试剂是________________。
| A.淀粉一碘化钾溶液 | B.NaOH溶液 | C.酚酞溶液 | D.硝酸酸化的AgNO3溶液 |
(3)氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快,较强,毒性较低,其结构
简式为 ,它可以以甲苯为原料合成
,它可以以甲苯为原料合成 ,其反应方程式为______________________________________,再经过________________反应(填反应类型)来合成
,其反应方程式为______________________________________,再经过________________反应(填反应类型)来合成 ,再经过一系列反应来合成。
,再经过一系列反应来合成。
(4)作为麻醉剂,氙气在医学上也生受重视,氙能溶于细胞质的油脂里,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止。人们曾试用体积分数为80%的氙气和20%的氧气组成的混合气作为无副作用的麻醉剂。氙在元素周期表中位于___________周期,________族,此麻醉剂的平均式量为________。
(14分) 某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得的资料如下:
①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te;
③氧气、硫、硒、碲与1 mol H2反应的焓变(△H)情况如下表所示。
| 物质 |
O2 |
S |
Se |
Te |
| ΔH(kJ·mol-1) |
-242 |
-20 |
81 |
请回答下列问题:
(1)写出氧族元素中含有18个电子的两种氢化物的化学式、。
(2)写出硒化氢发生分解反应的热化学方程式:。
(3)已知H2Te分解反应的ΔS>0,ΔH=-154 kJ·mol-1,请解释Te和H2不能直接化合的原因
。
(4)H2S的水溶液显弱酸性,写出其电离方程式;它的第一级电离常数可用Ka1来表示,当温度升高时,Ka1的值 (填“一定增大”、“一定减小”或“不能确定”)。
(填“一定增大”、“一定减小”或“不能确定”)。
(5)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别充入2 mol SO2、1 molO2和4 mol SO2、2 mol O2,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和α(乙),则反应的平衡常数Kc=L·mol-1(填写具体数据),此时α(乙)50%(填“大于”、“小于”或“等于”)。
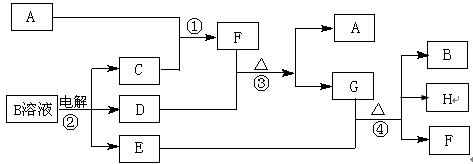
下图为中学化学中几种常见物质之间的转化关系。已知:(1)A、C、D是常见的气体单质,(2)F气体极易溶于水,且液态常用做制冷剂。(3)G为易溶性的盐,E为白色沉淀。(4)H为无色液体化合物。
|