铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下: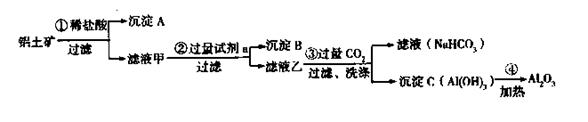
(1)沉淀A、B的成分分别是 、 ;
(2)步骤②中的试剂a是 ;
(3)试写出步骤③中发生反应的离子方式 ;
(4)在实验室模拟上述实验过程中,需要用到一定浓度的盐酸溶液。在配制250mi。该盐酸溶液时,某同学转移溶液的操作如图所示,图中的主要错误是: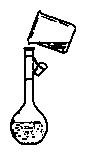
① ;
② 。
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如图所示,则所用盐酸溶液的物质的量浓度为 ,样品中Al2O3的百分含量为 。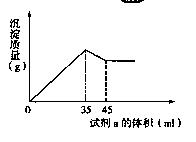
(化学一物质结构与性质,13分)铜及其化合物在现代生活中应用广泛。
(1)用黄铜矿炼铜的最后一步反应为:
①硫元素的基态原子核外电子排布式为__________________。
②铜元素的电离能: ___________
___________ (填“>"或“<")。
(填“>"或“<")。
③反应中形成的化学键类型为_________________。
(2)硫酸铜与有机物X按1:2反应生成配合物M,其配离子结构如图。
已知A为第二周期元素。
①配合物M的晶体类型为________________。
②构成配离子的元素中,有两种元素基态原子未成对电子数相同,这两种元素的电负性从大到小的顺序是_______________(填元素符号)。
③1 mo1有机物X中含 键的数目为________________。
键的数目为________________。
(3)Cu2+在生成[Cu(NH3)4]2+时,核外3d轨道上的1个未成对电子跃迁到4p轨道上,则Cu2+的轨道杂化方式不是sp3的原因是________________________。
[化学-物质结构与性质]碳、氮、氧、铁、铜是常见的几种元素,请回答以下问题:
(1)已知碳、氧、氯三种元素可形成CCl4、ClO:等物质,则C,O、Cl的电负性从大到小的顺序为______。
(2)基态铜原子的核外电子排布式为___________________________。
(3)三氯化铁常温下为固体,熔点282~C,沸点315~C,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为_________。
(4)lmolCH3COOH分子中含有ɑ键数目为___________。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为
①维生素B1中碳原子的杂化轨道类型有__________________
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________________。
| A.离子键、共价键 | B.离子键、氢键、共价键 |
| C.氢键、范德华力 | D.离子键、氢键、范德华力 |
(6)通常酸式盐在水中的溶解度大于正盐,但NaHCO3,的溶解度却小于Na2C03,这是由于____________。
(15分)
I.已知甲和乙在溶液中的转化关系如图所示:
请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的原子结构示意图为________________。
(2)若甲是10电子的阳离子,乙是碱性气体。lmol乙通人足量强酸溶液中与H+反应,反应过程中能量变化如图,该反应的热化学方程式是__________________________。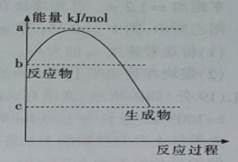
(3)若甲仅含有N03-、SO42-和X三种离子(不考虑水电离的H+、OH-),则X离子可能是_____________(填序号)。
| A.Fe2+ | B.HC03- | C.Ba2+ | D.Fe3+ |
(4)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=a,则HCO3-的电离平衡常数Ka=___.
Ⅱ.在恒容密闭容器中通入X并发生反应:  ,温度
,温度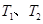
下X的物质的量浓度c(X)随时间t变化的曲线如图所示。
(5)温度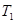 ___________
___________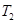 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(6)M点的正反应速率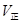 __________N点的逆反应速率
__________N点的逆反应速率 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(7)该反应进行到M点放出的热量与进行到W点放出的热量相比:_____________(填“更多”、“更少”或“相同”)
选考[化学一选修3:物质结构与性质]砷化稼为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。己知砷化稼的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是____(填序号)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.第一电离能As>Ga |
| C.电负性As>Ga |
| D.原子半径As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_________________;
(3)AsH3空间形状为_______;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因___________,Cu2+的核外电子排布式为_________________
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有___________和____________。
选考[化学与技术]根据废水中所含有害物质的不同,工业上有多种废水的处理方法。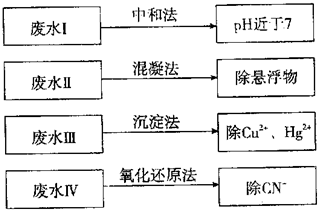
(1)①废水I若采用CO2处理,离子方程式是______.
②废水Ⅱ常用明矾处理.实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为______.
③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++______═CH3Hg++_____
我国规定,Hg2+的排放标准不能超过0.05mg/L.对于含Hg2+的污水,可加入沉淀剂_______(填写化学式),使Hg2+除去,降低污染。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为______.
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液.
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热.
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定.终点时消耗硫酸亚铁铵溶液V2 mL.
①I中,量取K2Cr207,溶液的仪器是______.
②Ⅲ中,发生的反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=______(用含c、V1、V2的表达式表示).