选考[化学一选修3:物质结构与性质]砷化稼为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。己知砷化稼的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是____(填序号)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.第一电离能As>Ga |
| C.电负性As>Ga |
| D.原子半径As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_________________;
(3)AsH3空间形状为_______;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因___________,Cu2+的核外电子排布式为_________________
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有___________和____________。
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
已知:
请写出NO与CO反应生成无污染气体的热化学方程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0.20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温”、“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。
合成治疗脑缺血的药物I的一种路线如下:
已知:
①
②I结构中分别有一个五原子环和一个六原子环。
③F能发生银镜反应。
完成下列填空:
(1)D→E的反应类型为______;F中不含氧的官能团有_________(写名称)。
(2)按系统命名法,A的名称是_______;I的结构简式为__________。
(3)H在一定条件下可以合成高分子树脂,其化学方程式为_____________________。
(4)G的同分异构体有多种,其中含有酚羟基,且结构中有4种不同性质氢的结构有_____种。
(5)化合物D经下列步骤可以得到苯乙烯:
反应Ⅰ的条件为________________;试剂X是_______________;
反应Ⅱ的化学方程式为___________________________________。
(1)硫元素位于元素周期表第____列;硫元素原子核外有2个未成对电子,这2个电子所处亚层的符号是_______;硫、氯元素的原子均可形成与Ar原子电子层结构相同的简单离子,且硫离子的半径更大,请解释____________________________。
(2)S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有________个S-S键;
己知:H-S键键能:339 kJ/mol; H-Se键键能:314kJ/mol。以上键能数据能否比较S,Se非金属性的强弱_______(选填“能”、“否”;下同);能否比较H2S、H2Se沸点的高低_______。
(3)在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此断NaHSO3溶液显_____性。
(4)在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32- )=c(HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)_____________________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)= c(OH-)
c.c(Na+)+ c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)己知Na2SO3溶液中存在水解平衡:SO32-+H2O HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是________,操作和现象是___________.
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是________,操作和现象是___________.
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2⇌CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
(1)Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)
(2)碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是 、 。温度偏低也不利于碳化反应,原因是 。
(3)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10 min到13 min之内钙离子的反 应速率为 。15 min之后钙离子浓度增大,原因是 (用化学方程式表示)。
(4)Mg原子核外电子排布式为 ;Ca原子最外层电子的能量 Mg原子最外层电子的能量(选填“低于”、“高于”或“等于”)。
(共14分)从薄荷油中得到一种烃A(C10H16),叫α-非兰烃,与A相关反应如下: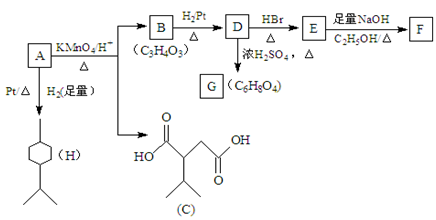
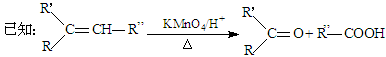
(即碳碳双键的碳原子上若有一个氢原子,氧化后形成羧基,若无氢原子,则氧化后生成羰基)
(1)D→E的反应类型为 。
(2)B所含官能团的名称为 。
(3)G为含六元环的化合物,写出其结构简式 。
(4)F在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂的链节为 。
(5)写出E→F(已知F的分子式C3H3O2Na)的化学方程式 。
(6)A与Br2加成后的可能产物共有 种(不考虑立体异构)
(7)C的同分异构体有多种,写出一种满足下列条件的同分异构体的结构简式 。
①含两个—COOCH3基团
②核磁共振氢谱呈现2个吸收峰